题目内容
 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.实验操作Ⅰ:在试管中加入5mL 1mol/L NaOH溶液和5mL溴乙烷,振荡.
实验操作Ⅱ:将试管如图固定后,水浴加热.
(1)用水浴加热而不直接用酒精灯加热的原因是
(2)观察到
(3)写出溴乙烷在NaOH醇溶液中发生反应的化学方程式
(4)为证明溴乙烷在NaOH的醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是生成的气体,检验的方法是
考点:性质实验方案的设计
专题:实验设计题
分析:(1)溴乙烷沸点低,溴乙烷易挥发,用水浴加热热均匀,减少溴乙烷的损失;
(2)溴乙烷不溶于水,开始溶液分层,生成物乙醇、溴化钠都溶于水;
(3)溴乙烷与NaOH的乙醇溶液反应生成乙烯、溴化钠、和水,其化学方程式为:CH3CH2Br+NaOH
CH2=CH2↑+NaBr+H2O;
(4)检验乙烯可根据其能使酸性KMnO4溶液或溴水褪色的原理来进行,可以采用洗气的装置,观察到酸性KMnO4溶液褪色且有气泡产生,溴水或溴的四氯化碳溶液褪色即可.
(2)溴乙烷不溶于水,开始溶液分层,生成物乙醇、溴化钠都溶于水;
(3)溴乙烷与NaOH的乙醇溶液反应生成乙烯、溴化钠、和水,其化学方程式为:CH3CH2Br+NaOH
| 乙醇 |
| △ |
(4)检验乙烯可根据其能使酸性KMnO4溶液或溴水褪色的原理来进行,可以采用洗气的装置,观察到酸性KMnO4溶液褪色且有气泡产生,溴水或溴的四氯化碳溶液褪色即可.
解答:
解:溴乙烷与氢氧化钠反应生成乙醇与溴化钠,
(1)溴乙烷沸点低,溴乙烷易挥发,用水浴加热热均匀,减少溴乙烷的损失,故答案为:使试管受热均匀,减少溴乙烷的损失;
(2)溴乙烷不溶于水,开始溶液分层,生成的产物乙醇、溴化钠都易溶于水,当溶液分层消失,表明溴乙烷与NaOH溶液已完全反应,反应化学方程式为:CH3CH2Br+NaOH
CH3CH2OH+NaBr,故答案为:试管内溶液静置后不分层;CH3CH2Br+NaOH
CH3CH2OH+NaBr;
(3)溴乙烷与NaOH的乙醇溶液反应生成乙烯、溴化钠、和水,其化学方程式为:CH3CH2Br+NaOH
CH2=CH2↑+NaBr+H2O,故答案为:CH3CH2Br+NaOH
CH2=CH2↑+NaBr+H2O;
(4)溴乙烷发生消去反应生成乙烯,所以应检验生成的有机物乙烯,检验乙烯可根据其能使酸性KMnO4溶液或溴水褪色的原理来进行,可以采用洗气的装置,观察到酸性KMnO4溶液褪色且有气泡产生,溴水或溴的四氯化碳溶液褪色即可
,故答案为:将生成的气体先通过盛有水的试管,再通入盛有KMnO4溶液的试管,KMnO4溶液褪色(或直接通入溴的四氯化碳溶液,溴水褪色).
(1)溴乙烷沸点低,溴乙烷易挥发,用水浴加热热均匀,减少溴乙烷的损失,故答案为:使试管受热均匀,减少溴乙烷的损失;
(2)溴乙烷不溶于水,开始溶液分层,生成的产物乙醇、溴化钠都易溶于水,当溶液分层消失,表明溴乙烷与NaOH溶液已完全反应,反应化学方程式为:CH3CH2Br+NaOH
| ||
| △ |
| ||
| △ |
(3)溴乙烷与NaOH的乙醇溶液反应生成乙烯、溴化钠、和水,其化学方程式为:CH3CH2Br+NaOH
| 乙醇 |
| △ |
| 乙醇 |
| △ |
(4)溴乙烷发生消去反应生成乙烯,所以应检验生成的有机物乙烯,检验乙烯可根据其能使酸性KMnO4溶液或溴水褪色的原理来进行,可以采用洗气的装置,观察到酸性KMnO4溶液褪色且有气泡产生,溴水或溴的四氯化碳溶液褪色即可
,故答案为:将生成的气体先通过盛有水的试管,再通入盛有KMnO4溶液的试管,KMnO4溶液褪色(或直接通入溴的四氯化碳溶液,溴水褪色).
点评:本题考查了卤代烃的性质,注意溴乙烷发生取代反应,生成乙醇与氢溴酸;发生消去反应,生成乙烯和氢溴酸.

练习册系列答案
相关题目
用下列装置不能达到有关实验目的是( )
A、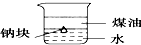 证明ρ(煤油)<ρ(钠)<ρ(水) |
B、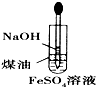 制备Fe(OH)2 |
C、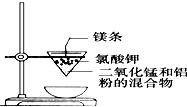 制取金属锰 |
D、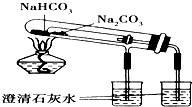 比较NaHCO3和Na2CO3的热稳定性 |
用简便的方法鉴别硫酸铜、碳酸钠、氢氧化镁三种白色固体粉末,应选用的最佳试剂是( )
| A、稀盐酸 | B、紫色石蕊试液 |
| C、水 | D、氢氧化钠溶液 |
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)=2Z(g)+W(s)△H<0,下列叙述正确的是( )
| A、达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数 |
| B、达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动 |
| C、达到平衡时,反应速率v正(X)=2v逆(Z) |
| D、平衡常数K值越大,X的转化率越大 |
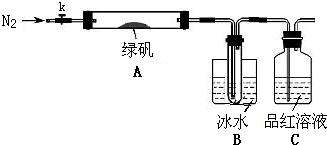 某学习小组拟通过实验探究绿矾(FeSO4?7H2O)热分解的产物.
某学习小组拟通过实验探究绿矾(FeSO4?7H2O)热分解的产物.