题目内容
 研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义.
研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义.(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示)
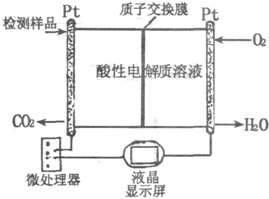
(2)右图所示是用于合成甲醇产品中甲醇含量的检测仪.写出该仪器工作时的电极反应式:
负极
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3、NO的体积比保持不变D.每消耗 1mol SO2,同时生成1mol NO当测得上述平衡体系中NO2与SO2体积比为1:6时,则该反应平衡常数K值为
(4)工业常用Na2CO3饱和溶液回收NO、NO2气体:NO+NO2+Na2CO3═2NaNO2+CO2 2NO2+Na2CO3═NaNO3+NaNO2+CO2若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为
考点:化学平衡状态的判断,化学电源新型电池,化学平衡常数的含义,化学平衡的计算
专题:化学平衡专题,电化学专题
分析:(1)根据“绿色化学”的特征:反应物中原子全部转化为欲制得的产物,即原子的利用率为100%;
(2)根据得失电子及反应类型书写电极反应式;
(3)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;利用三段法计算平衡时的浓度来计算化学平衡常数;
(4)根据二氧化碳气体体积和溶液质量增加的量列方程组解出一氧化氮和二氧化氮的体积,从而得出其体积之比.
(2)根据得失电子及反应类型书写电极反应式;
(3)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;利用三段法计算平衡时的浓度来计算化学平衡常数;
(4)根据二氧化碳气体体积和溶液质量增加的量列方程组解出一氧化氮和二氧化氮的体积,从而得出其体积之比.
解答:
解:(1)以CO与H2为原料,在一定条件下均可合成甲醇:CO(g)+2H2(g)
CH3OH(g);
以CO2与H2为原料,在一定条件下均可合成甲醇:CO2(g)+3H2(g)
CH3OH(g))+H2O,
以CO与H2为原料,产物只有一种吗,符合符合“绿色化学”的思想,
故答案为:CO(g)+2H2(g)
CH3OH(g);
(2)燃料燃烧时,燃料失电子发生氧化反应,氧气得电子发生还原反应;原电池中负极上发生氧化反应,正极上发生还原反应,所以燃料在负极上发生反应,氧气在正极上发生反应;正极上氧气得电子和氢离子反应生成水;负极上燃料失电子和水反应生成氢离子和二氧化碳.电极反应式为:
负极:2CH3OH+2H2O-12e-═12H++2CO2,正极:3O2+12H++12e-═6H2O,
故答案为:2CH3OH+2H2O-12e-═12H++2CO2;3O2+12H++12e-═6H2O;
(3)A.反应前后气体的体积不变,故体系压强保持不变不能作为判断是否达到化学平衡状态的依据,故A错误;
B.NO2为红棕色气体,SO2、SO3(g)和NO为无色气体,故混合气体颜色保持不变可作为判断是否达到化学平衡状态的依据,故B正确;
C.平衡时各物质的体积之比取决于物质的起始物质的量和转化率,故SO3、NO的体积比保持不变不能作为判断是否达到平衡状态的依据,故C错误;
D.消耗 1mol SO2是正反应,同时生成1mol NO也是正反应,故D错误,
NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
起始物质的体积 1a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 1a-x 2a-x x x
则(1a-x):(2a-x)=1:6,故x=0.8a,故K=
=2.67,
故答案为:B;2.67;
(4)①设NO的物质的量是x,NO2的物质的量是y,则
解得:x=
,y=
;即一氧化氮和二氧化氮的物质的量之比为:
:
=1:7,所以相同条件下,一氧化氮和二氧化氮的体积之比是1:7,
故答案为:1:7.
| 一定条件 |
以CO2与H2为原料,在一定条件下均可合成甲醇:CO2(g)+3H2(g)
| 一定条件 |
以CO与H2为原料,产物只有一种吗,符合符合“绿色化学”的思想,
故答案为:CO(g)+2H2(g)
| 一定条件 |
(2)燃料燃烧时,燃料失电子发生氧化反应,氧气得电子发生还原反应;原电池中负极上发生氧化反应,正极上发生还原反应,所以燃料在负极上发生反应,氧气在正极上发生反应;正极上氧气得电子和氢离子反应生成水;负极上燃料失电子和水反应生成氢离子和二氧化碳.电极反应式为:
负极:2CH3OH+2H2O-12e-═12H++2CO2,正极:3O2+12H++12e-═6H2O,
故答案为:2CH3OH+2H2O-12e-═12H++2CO2;3O2+12H++12e-═6H2O;
(3)A.反应前后气体的体积不变,故体系压强保持不变不能作为判断是否达到化学平衡状态的依据,故A错误;
B.NO2为红棕色气体,SO2、SO3(g)和NO为无色气体,故混合气体颜色保持不变可作为判断是否达到化学平衡状态的依据,故B正确;
C.平衡时各物质的体积之比取决于物质的起始物质的量和转化率,故SO3、NO的体积比保持不变不能作为判断是否达到平衡状态的依据,故C错误;
D.消耗 1mol SO2是正反应,同时生成1mol NO也是正反应,故D错误,
NO2(g)+SO2(g)
 SO3(g)+NO(g)
SO3(g)+NO(g)起始物质的体积 1a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 1a-x 2a-x x x
则(1a-x):(2a-x)=1:6,故x=0.8a,故K=
| 0.8a×0.8a |
| (1a-0.8a)×(2a-0.8a) |
故答案为:B;2.67;
(4)①设NO的物质的量是x,NO2的物质的量是y,则
|
解得:x=
| 1 |
| 4 |
| 7 |
| 4 |
| 1 |
| 4 |
| 7 |
| 4 |
故答案为:1:7.
点评:本题考查绿色化学、燃料电池、化学平衡的标志、平衡常数的计算以及物质的量的相关计算,综合性较强,难度中等.

练习册系列答案
相关题目
对下列反应①KHCO3溶液与石灰水反应、②Na2SO3溶液与稀盐酸反应、③Si与烧碱溶液反应、④Fe与稀硝酸反应.改变反应物用量,不能用同一个离子方程式表示的是( )
| A、①②③ | B、①②④ |
| C、①③④ | D、②③④ |
下列叙述中正确的是( )
| A、电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| B、向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| C、常温下,将pH=10的氨水稀释,溶液中所有离子浓度都减小 |
| D、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的2倍.下列说法不正确的是( )
| A、X的氢化物溶液与其最高价氧化物对应的水化物溶液的酸碱性相反 |
| B、Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料 |
| C、X和Z的最高价氧化物对应的水化物的浓溶液都是具有强氧化性的酸 |
| D、Z的氢化物比X的氢化物更稳定 |
下列各物质中,属于电解质且溶于水后溶液呈酸性的是( )
| A、HNO3 |
| B、NaOH |
| C、NH3 |
| D、Na |
下列解释事实的离子方程式不正确的是( )
| A、氯化铜溶液显酸性:Cu2++2H2O?Cu(OH)2+2H+ |
| B、氯气使湿润的淀粉KI试纸变蓝:Cl2+2I-=2Cl-+I2 |
| C、向硫酸铝溶液中加入氨水出现白色胶状沉淀:Al3++3OH-?Al(OH)3↓ |
| D、实验室不用玻璃塞试剂瓶盛装氢氧化钠溶液:SiO2+2OH-?SiO32-+H2O |
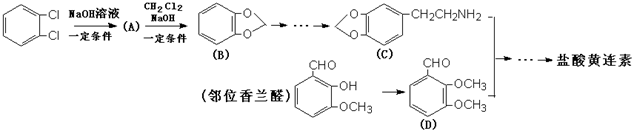

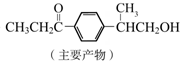 +HCl
+HCl
 与1分子
与1分子  也可以发生类似反应①的反应,有机化合物结构简式为
也可以发生类似反应①的反应,有机化合物结构简式为