题目内容
9.用水稀释0.1 mol•L-1 CH3COOH时,溶液中随着水量的增加而减小的是( )| A. | $\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$ | B. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ | C. | c(H+)和c(OH-)的乘积 | D. | OH-的物质的量 |
分析 CH3COOH溶液中存在CH3COOH?CH3COO-+H+,加水稀释促进电离,溶液中n(CH3COO-)和n(H+)增大,但浓度减小,一定温度下存在离子积常数,氢离子女方和氢氧根离子浓度乘积为常数,以此解答该题.
解答 解:在用水稀释过程中,促进醋酸的电离,醋酸分子的物质的量减小,浓度减小;氢离子的物质的量增大,浓度减小;氢氧根的物质的量增大,浓度增加;温度不变Kw始终不变,
A.溶液体积相同可以用醋酸和氢氧根离子物质的量比值判断,稀释过程中醋酸分子的物质的量减小,氢氧根的物质的量增大,$\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$比值减小,故A正确;
B.加入水稀释,促进电离,氢离子浓度减小,温度一定溶液中存在离子积常数,氢氧根离子浓度增大,所以$\frac{c(O{H}^{-})}{c({H}^{+})}$比值增大,故B错误;
C.温度一定溶液中存在离子积常数,c(H+)和c(OH-)的乘积不变,故C错误;
D.加水稀释促进电离,溶液中c(CH3COO-)和c(H+)减小,c(OH-)浓度增大,氢氧根离子数增大,故D错误;
故选A.
点评 本题考查弱电解质的电离平衡问题、温度一定溶液中存在离子积常数,题目难度不大,注意把握弱电解质电离的特征以及影响平衡移动的因素.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.某卤代烃与氢氧化钠的醇溶液在加热条件下反应产生丙烯,将剩余的溶液用硝酸酸化后,加入硝酸银溶液生成浅黄色沉淀.则原卤代烃的结构简式可能是( )
| A. | CH3CH2CH2-Cl | B. | 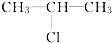 | C. | CH3CH2CH2-Br | D. | 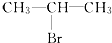 |
20.对于放热反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,下列说法中,正确的是( )
| A. | 生成物所具有的总能量高于反应物所具有的总能量 | |
| B. | 反应物所具有的总能量高于生成物所具有的总能量 | |
| C. | 断开1molH-H键和1molCl-Cl键所吸收的总能量大于形成2molH-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
17.室温下,用0.10mol•L-1盐酸分别滴定20.00mL 0.10mol•L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积V(HCl)的变化关系如图.下列说法不正确的是( )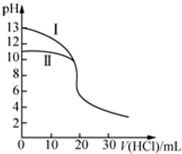

| A. | Ⅱ表示的是滴定氨水的曲线,当V(HCl)=20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 当pH=7时,滴定氨水消耗的V(HCl)<20 mL,且c(NH4+)=c(Cl-) | |
| C. | 滴定氢氧化钠溶液时,若V(HCl)>20 mL,则一定有:c(Cl-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 当滴定氨水消耗V(HCl)=10 mL时,有:2[c(OH-)-c(H+)]=c(NH4+)-c(NH3•H2O) |
4.下列说法正确的是( )
| A. | $\stackrel{235}{92}$U和$\stackrel{238}{92}$U是中子数不同质子数相同的同种核素 | |
| B. | 质子数为53,中子数为78的碘原子:$\stackrel{131}{53}$I | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | 通过化学变化可以实现16O与18O间的相互转化 |
14.下列事故的处理错误的是( )
| A. | 将CO中毒者移到通风处抢救 | |
| B. | 不慎将浓硫酸溅到皮肤上,应立即用少量水冲洗 | |
| C. | 不慎碰倒酒精灯,洒出的酒精在桌上燃烧时,应立即用湿抹布盖灭 | |
| D. | 眼睛里不慎溅进了药液,应立即用水冲洗,边洗边眨眼睛,不可用手揉 |
18.下列选项中的物质,能用分液漏斗分离的是( )
| A. | 酒精和水 | B. | 四氯化碳和水 | C. | 乙酸和水 | D. | 汽油和苯 |
9.下列说法中正确的是( )
| A. | PCl3分子是三角锥形,这是因为P原子是以sp2杂化的结果 | |
| B. | sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道 | |
| C. | 凡中心原子采取sp3杂化的分子,其VSEPR模型都是四面体 | |
| D. | AB3型的分子立体构型必为平面三角形 |
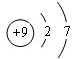 ,D离子的结构示意图:
,D离子的结构示意图: .
.