题目内容
9.在Cl2、NO、SO2、NO2、NH3五种气体中,与空气相遇能立即变色的是NO;常用于自来水杀菌、消毒的是Cl2;能用向下排空气法收集的是NH3;溶于水后能生成强酸的是Cl2和NO2.分析 NO具有强的还原性,空气中容易被氧化为二氧化氮;氯气与水反应生成的次氯酸具有强的氧化性,能够杀菌消毒;向下排空气法收集的气体其密度应小于空气密度;氯气与水反应生成的氯化氢和二氧化氮与水生成的硝酸为强酸.
解答 解:NO为无色气体,具有强的还原性,空气中容易被氧化为二氧化氮,二氧化氮为红棕色;
氯气与水反应生成的次氯酸具有强的氧化性,能够杀菌消毒,常用于自来水杀菌、消毒;
向下排空气法收集的气体其密度应小于空气密度,符合条件的气体为氨气;
氯气与水反应生成的氯化氢和二氧化氮与水生成的硝酸为强酸;
故答案为:NO;Cl2;NH3;Cl2和NO2.
点评 本题考查较综合,侧重物质性质的考查,熟悉常见物质之间的反应即可解答,注重基础知识的考查,题目较简单.

练习册系列答案
相关题目
17.中和相同体积、相同pH的Ba(OH)2、NaOH和NH3H2O三种溶液,所用相同浓度的盐酸的体积分别为V1、V2、V3,则三者关系为( )
| A. | V3>V1=V2 | B. | V3=V2>V1 | C. | V3>V2>V1 | D. | V1=V2>V3 |
4.从1L1mol/L的氯化钾溶液中取出50mL溶液,该50mL氯化钾溶液的物质的量浓度为( )
| A. | 0.02 mol/L | B. | 0.05 mol/L | C. | 1 mol/L | D. | 2mol/L |
14.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末;有气泡产生,说明氯水中含有H+ | |
| D. | 氯水中加入氢氧化钠溶液,氯水的黄绿色消失,说明氯水中含有HClO |
3.下列反应的离子方程式书写正确的是( )
| A. | 稀盐酸与稀氨水反应:H++OH-═H2O | |
| B. | 溴化钠溶液与氯气反应:2Br-+Cl2=═Br2+2Cl- | |
| C. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 二氧化氮与水反应:2NO2+2H2O═2H++2NO${\;}_{3}^{-}$+H2 |
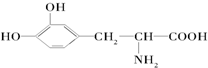 .这种药物的研制是基于获得2000年诺贝尔生理学和医学奖的研究结果.L多巴分子中不含有的官能团是( )
.这种药物的研制是基于获得2000年诺贝尔生理学和医学奖的研究结果.L多巴分子中不含有的官能团是( )