题目内容
1.铝粉与某些金属氧化物组成的混合物叫铝热剂,铝热剂在高温下发生的反应叫铝热反应.如:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3,反应发生时放出大量的热.仔细阅读上述信息回答下列问题:(1)“铝热反应”属于四种基本反应类型中的置换反应反应.
(2)下列氧化物与铝粉混合可作铝热剂的是AC
A.Fe3O4 B.MgO C.CuO D.P2O5
(3)试写出铝粉与MnO2发生的铝热反应方程式3MnO2+4Al$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3.
(4)题给的铝热反应可用于野外焊接钢轨,其基本原理是该反应发生时放出大量的热.
分析 (1)铝热反应特点:一种单质与一种化合物反应生成另一种单质和另一种化合物,判断反应类型;
(2)铝热反应可冶炼熔点高的活泼性比Al弱的金属,以此来解答;
(3)铝与二氧化锰在高温下反应生成锰和氧化铝;
(4)铝和氧化铁能发生铝热反应且放出大量热.
解答 解:(1)铝热反应特点:一种单质与一种化合物反应生成另一种单质和另一种化合物,符合置换反应的定义,属于置换反应;
故答案为:置换反应;
(2)铝热反应属于氧化还原反应,遵循氧化还原反应强弱规律,制备的金属还原性弱于铝,活泼性弱于铝,满足条件的只有AC,
故答案为:AC;
(3)铝与二氧化锰在高温下反应生成锰和氧化铝,化学方程式为:3MnO2+4Al $\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3,
故答案为:3MnO2+4Al $\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3;
(4)铝和氧化铁能发生铝热反应且放出大量热,从而用于焊接钢轨,
故答案为:该反应发生时放出大量的热.
点评 本题Al的性质及铝热反应,为高频考点,把握金属的活泼性为解答的关键,注意铝热反应的特点及金属冶炼原理,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.铅蓄电池是机动车上常用的化学电源,其两极分别为Pb、PbO2,电解质溶液为硫酸,工作时反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,下列结论正确的是( )
| A. | Pb为正极被氧化 | B. | PbO2为负极被氧化Pb | ||
| C. | 电解质溶液浓度不断减小 | D. | 溶液的PH不断减小 |
8.下列关于有机物  的叙述中,不正确的是( )
的叙述中,不正确的是( )
 的叙述中,不正确的是( )
的叙述中,不正确的是( )| A. | 它难溶于水,但易溶于苯,工业上可以用苯和丙烯加成反应制得 | |
| B. | 它会使酸性高锰酸钾溶液褪色 | |
| C. | 它有三种一溴代物 | |
| D. | 一定温度下可以和浓硝酸、浓硫酸的混合物发生硝化反应 |
5.如图表示碱金属的某些性质与核电荷数的变化关系,下列各性质中不符合图示关系的是( ) 

| A. | 还原性 | B. | 与水反应的剧烈程度 | ||
| C. | 最高价氧化物对应水化物的碱性 | D. | 简单阳离子的氧化性 |
12.下列操作过程中不能出现“先产生沉淀然后又完全溶解”现象的是( )
| A. | 向Ca(ClO)2溶液中通入CO2至过量 | |
| B. | 向Na2SiO3溶液中滴加盐酸溶液至过量 | |
| C. | 向氢氧化铁胶体中滴加稀硫酸至过量 | |
| D. | 向Na[Al(OH)4]溶液中滴加盐酸至过量 |
6.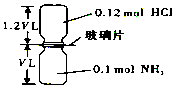 如图,抽去如图所示装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.(已知反应:HCl+NH3═NH4Cl(固体))下列说法正确的是( )
如图,抽去如图所示装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.(已知反应:HCl+NH3═NH4Cl(固体))下列说法正确的是( )
 如图,抽去如图所示装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.(已知反应:HCl+NH3═NH4Cl(固体))下列说法正确的是( )
如图,抽去如图所示装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.(已知反应:HCl+NH3═NH4Cl(固体))下列说法正确的是( )| A. | 反应后瓶内压强是反应前的$\frac{1}{10}$ | |
| B. | 装置中氢元素的总质量为0.42g | |
| C. | 生成物的分子数目为0.1NA | |
| D. | 反应结束后,两个集气瓶很容易分开 |




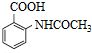 的合成路线流程图(无机试剂任用).合成路线流程图示例:CH2CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br$→_{△}^{NaOH水溶液}$CH2OHCH2OH
的合成路线流程图(无机试剂任用).合成路线流程图示例:CH2CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br$→_{△}^{NaOH水溶液}$CH2OHCH2OH