题目内容
NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、1L 0.1 mol?L-1 NaCl溶液中含0.1NA个Na+ |
| B、22.4L NH3含4NA个原子 |
| C、标准状况下,22.4L H2O中含有10NA个电子 |
| D、NA个SO2分子的质量为64 g/mol |
考点:阿伏加德罗常数
专题:
分析:A.根据n=cV计算出氯化钠的物质的量,然后计算出钠离子的物质的量;
B.没有告诉在标况下,不能使用标况下的气体摩尔体积计算氨气的物质的量;
C.标准状况下,水的状态不是气体,不能使用标况下的气体摩尔体积计算水的物质的量;
D.质量的单位为g,g/mol为摩尔质量的单位.
B.没有告诉在标况下,不能使用标况下的气体摩尔体积计算氨气的物质的量;
C.标准状况下,水的状态不是气体,不能使用标况下的气体摩尔体积计算水的物质的量;
D.质量的单位为g,g/mol为摩尔质量的单位.
解答:
解:A.1L 0.1 mol?L-1 NaCl溶液中含有氯化钠的物质的量为0.1mol,0.1mol氯化钠中含有0.1mol钠离子,含0.1NA个Na+,故A正确;
B.不是标况下,不能使用标况下22.4L氨气的物质的量,故B错误;
C.标况下水不是气体,不能使用标况下的气体摩尔体积计算水的物质的量,故C错误;
D.二氧化硫的摩尔质量为64g/mol,NA个SO2分子的物质的量为1mol,质量为64g,故D错误;
故选A.
B.不是标况下,不能使用标况下22.4L氨气的物质的量,故B错误;
C.标况下水不是气体,不能使用标况下的气体摩尔体积计算水的物质的量,故C错误;
D.二氧化硫的摩尔质量为64g/mol,NA个SO2分子的物质的量为1mol,质量为64g,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的应用,题目难度中等,试题侧重标况下气体摩尔体积的使用条件,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件为解答关键.

练习册系列答案
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
下列说法在一定条件下可以实现的是( )
①非金属置换金属的反应
②弱酸反应可以生成强酸
③有单质参加的非氧化还原反应
④没有水生成,也没有沉淀和气体生成的复分解反应.
①非金属置换金属的反应
②弱酸反应可以生成强酸
③有单质参加的非氧化还原反应
④没有水生成,也没有沉淀和气体生成的复分解反应.
| A、②④ | B、①③④ |
| C、①②③ | D、①②③④ |
在物质分类中,前者包括后者的是( )
| A、氧化物、化合物 |
| B、溶液、胶体 |
| C、分散系、溶液 |
| D、酸性氧化物、化合物 |
已知阿伏加德罗常数NA约为6.02×1023mol-1,现测定出一定量的水中含有2NA个水分子.则该水的物质的量为( )
| A、0.2mol |
| B、0.5mol |
| C、1mol |
| D、2mol |
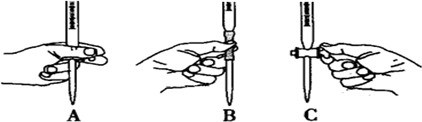
下列实验基本操作中,正确的是( )
A、 |
B、 |
C、 |
D、 |
 化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如图.关于A的下列说法中,正确的是(双选)( )
化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如图.关于A的下列说法中,正确的是(双选)( )| A、A分子属于酯类化合物,在一定条件下能发生水解反应 |
| B、A在一定条件下可与4 mol H2发生加成反应 |
| C、符合题中A分子结构特征的有机物只有1种 |
| D、与A属于同类化合物的同分异构体只有2种 |