题目内容
氢气的制取与储存是氢能源利用领域的研究热点.
(1)已知:2H2S(g)═2H2(g)+S2(g)△H=169.8kJ?mol-1
下列有关该反应的叙述正确的是
A.正反应活化能小于169.8kJ?mol-1
B.逆反应活化能一定小于169.8kJ?mol-1
C.正反应活化能不小于169.8kJ?mol-1
D.正反应活化能比逆反应活化能小于169.8kJ?mol-1
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是 .
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系,如图1所示.在4000℃~5000℃时可能发生下列哪些反应 (填写字母).
A.2H2O
2H2+O2 B.H2
2H C.O2
2O
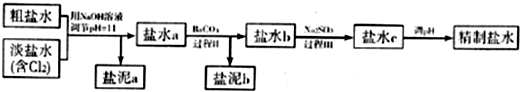
(4)制取氢气的另一种方法是电解尿素[CO(NH2)2]的碱性溶液,装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).该电解装置中电解排出液中的主要成分是 (写化学式).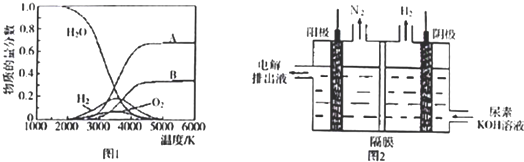
(5)已知下列物质的KSP:CaCO3×10-9;BaSO4,1×10-10;BaCO3 5×10-8;Mg(OH)2 5.6×10-12;
Ca(OH)2;1.4×10-5.氯碱工业中 电解饱和食盐水也能得到氢气,电解所用的盐水需精制,去除有影响的Ca2+、Mg2+、
NH+4、SO2-4[c(SO2-4)>c(Ca2+)].某精制流程如下:
①盐泥a除泥沙外,还含有的物质是 .
②过程I中将NH+4转化为N2的离子方程式是 .
③过程II中除去的离子有 .
④经过程III处理,需求盐水c中剩余Na2SO3的含量小于5mg/L.若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b,至多添加10%Na2SO3溶液 kg(溶液体积变化忽略不计)
(1)已知:2H2S(g)═2H2(g)+S2(g)△H=169.8kJ?mol-1
下列有关该反应的叙述正确的是
A.正反应活化能小于169.8kJ?mol-1
B.逆反应活化能一定小于169.8kJ?mol-1
C.正反应活化能不小于169.8kJ?mol-1
D.正反应活化能比逆反应活化能小于169.8kJ?mol-1
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系,如图1所示.在4000℃~5000℃时可能发生下列哪些反应
A.2H2O
| ||
| ||
| ||
(4)制取氢气的另一种方法是电解尿素[CO(NH2)2]的碱性溶液,装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).该电解装置中电解排出液中的主要成分是

(5)已知下列物质的KSP:CaCO3×10-9;BaSO4,1×10-10;BaCO3 5×10-8;Mg(OH)2 5.6×10-12;
Ca(OH)2;1.4×10-5.氯碱工业中 电解饱和食盐水也能得到氢气,电解所用的盐水需精制,去除有影响的Ca2+、Mg2+、
NH+4、SO2-4[c(SO2-4)>c(Ca2+)].某精制流程如下:
①盐泥a除泥沙外,还含有的物质是
②过程I中将NH+4转化为N2的离子方程式是
③过程II中除去的离子有
④经过程III处理,需求盐水c中剩余Na2SO3的含量小于5mg/L.若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b,至多添加10%Na2SO3溶液

考点:反应热和焓变,电解原理,物质分离和提纯的方法和基本操作综合应用
专题:基本概念与基本理论
分析:(1)根据△H=正反应活化能-逆反应活化能=169.8kJ?mol-1分析;
(2)使部分H2S燃烧,放出热量,为H2S热分解反应提供热量;
(3)根据化学反应的本质旧键的断裂和新键的形成以及高温下水分解体系中主要气体的成分;
(4)由图可知,CO(NH2)2在阳极放电生成N2,C元素价态未变化,故还有碳酸钾生成与水生成,同时KOH过量;
(5)①根据杂质离子和溶液的酸碱性判断能反应生成的沉淀;
②根据A溶液成分和可能具有的性质,结合氧化还原反应和质量守恒定律书写离子方程式;
③根据溶液成分和溶解度大小判断生成的沉淀;
④根据反应方程式和质量守恒解答.
(2)使部分H2S燃烧,放出热量,为H2S热分解反应提供热量;
(3)根据化学反应的本质旧键的断裂和新键的形成以及高温下水分解体系中主要气体的成分;
(4)由图可知,CO(NH2)2在阳极放电生成N2,C元素价态未变化,故还有碳酸钾生成与水生成,同时KOH过量;
(5)①根据杂质离子和溶液的酸碱性判断能反应生成的沉淀;
②根据A溶液成分和可能具有的性质,结合氧化还原反应和质量守恒定律书写离子方程式;
③根据溶液成分和溶解度大小判断生成的沉淀;
④根据反应方程式和质量守恒解答.
解答:
解:(1)由△H=正反应活化能-逆反应活化能=169.8kJ?mol-1得
A.正反应活化能大于169.8kJ?mol-1,故A错误;
B.逆反应活化能不一定小于169.8kJ?mol-1,故B错误;
C.正反应活化应大于169.8kJ?mol-1,故C正确;
D.正反应活化能比逆反应活化能大169.8kJ?mol-1,故D错误;
故选:C.
(2)使部分H2S燃烧,放出热量,为H2S热分解反应提供热量,故答案为:为H2S热分解反应提供热量;
(3)化学反应的本质旧键的断裂和新键的形成,故发生:H2
2H、O2
2O、高温下水分解体系中主要气体的成分为:H2O、H2、O2 故发生:2H2O
2H2+O2,故答案为:ABC;
(4)由图可知,CO(NH2)2在阳极放电生成N2,C元素价态未变化,故还有K2CO3与水生成,同时KOH过量,故答案为:K2CO3、KOH;
(5)①根据粗盐水和淡盐水的化学成分,结合题给精制盐水的流程进行分析,可知过程I是将Mg2+转化为Mg(OH)2沉淀除去,即盐泥a中除泥沙外,还含有的物质是Mg(OH)2,故答案为:Mg(OH)2;
②将NH4+转化为N2的氧化剂是Cl2,对应的离子方程式是2NH4++3Cl2+8OH-═N2↑+6Cl-+8H2O,故答案为:2NH4++3Cl2+8OH-═N2↑+6Cl-+8H2O;
③过程II是利用沉淀溶解平衡原理,将溶液中的Ca2+和SO42-分别转化为CaCO3和BaSO4沉淀除去,故答案为:SO42-、Ca2+;
④NaClO与Na2SO3溶液反应的化学方程式为:NaClO+Na2SO3═NaCl+Na2SO4,若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b时至少需要10%Na2SO3溶液
×126g/mol×
=1.26kg,若盐水c中剩余Na2SO3的含量为5mg/L,则还需添加10% Na2SO3溶液50g÷10%=0.5kg,因此至多添加10%Na2SO3溶液
的质量为1.26kg+0.5kg=1.76kg.故答案为:1.76.
A.正反应活化能大于169.8kJ?mol-1,故A错误;
B.逆反应活化能不一定小于169.8kJ?mol-1,故B错误;
C.正反应活化应大于169.8kJ?mol-1,故C正确;
D.正反应活化能比逆反应活化能大169.8kJ?mol-1,故D错误;
故选:C.
(2)使部分H2S燃烧,放出热量,为H2S热分解反应提供热量,故答案为:为H2S热分解反应提供热量;
(3)化学反应的本质旧键的断裂和新键的形成,故发生:H2
| ||
| ||
| ||
(4)由图可知,CO(NH2)2在阳极放电生成N2,C元素价态未变化,故还有K2CO3与水生成,同时KOH过量,故答案为:K2CO3、KOH;
(5)①根据粗盐水和淡盐水的化学成分,结合题给精制盐水的流程进行分析,可知过程I是将Mg2+转化为Mg(OH)2沉淀除去,即盐泥a中除泥沙外,还含有的物质是Mg(OH)2,故答案为:Mg(OH)2;
②将NH4+转化为N2的氧化剂是Cl2,对应的离子方程式是2NH4++3Cl2+8OH-═N2↑+6Cl-+8H2O,故答案为:2NH4++3Cl2+8OH-═N2↑+6Cl-+8H2O;
③过程II是利用沉淀溶解平衡原理,将溶液中的Ca2+和SO42-分别转化为CaCO3和BaSO4沉淀除去,故答案为:SO42-、Ca2+;
④NaClO与Na2SO3溶液反应的化学方程式为:NaClO+Na2SO3═NaCl+Na2SO4,若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b时至少需要10%Na2SO3溶液
| 74.5g |
| 74.5g?mol -1 |
| 100 |
| 10 |
的质量为1.26kg+0.5kg=1.76kg.故答案为:1.76.
点评:本题题目较为综合,考查了反应热的计算、电解原理、粗盐的提纯等,注意平衡移动原理的应用以及物质的量应用于化学方程式的计算.做题时注意题中所给信息,用守恒的方法解答.

练习册系列答案
相关题目
工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol、-283.0kJ/mol,则生成1 m3(标准状况)CO所需热量为( )
| A、247.3 kJ |
| B、494.6 kJ |
| C、2.76×103kJ |
| D、5.52×103kJ |
下列高聚物中,由两种不同的单体通过加聚反应制得的是( )
A、 |
B、 |
C、 |
D、 |
下列说法或表述正确的是( )
| A、由水电离产生的c(H+)=1×10-2mol?L-1溶液中,可能存在:CO32-、NH4+、Cl-,Na+ |
| B、某醋酸稀溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| C、Ba(OH)2溶液中加人过量的Al2(SO4)3溶液,其离子方程式为:3Ba2++60H-+2Al3++3SO42-=3BaS04↓+2Al(0H)3↓ |
| D、物质的量浓度均为1mol?L-1的NaCl和MgCl2混合液中,含有Cl-的数目为3NA(NA表示阿伏加德罗常数的值) |
下列判断中,正确的是( )
| A、30%和H2O2溶液中加入MnO2可制得O2,MnO2做氧化剂 |
| B、SO2和CO2都属于酸性氧化物,Na2O和Al2O3都属于碱性氧化物 |
| C、在NH4Cl水溶液中,既存在水解平衡,又存在电离平衡 |
| D、O2在放电条件下生成O3属于化学变化,煤干馏得到焦炭属于物理变化 |

 [化学-物质结构与性质]
[化学-物质结构与性质]