题目内容
设阿伏加德罗常数的值为NA,下列有关说法正确的是( )
| A、0.5mol苯分子中含有C=C双键数为1.5NA |
| B、2.8g乙烯、丙烯和聚乙烯的混合物中所含碳原子数为0.2NA |
| C、标准状况下,2.24L C5H12含有的共用电子对为1.6NA |
| D、1mol甲基(-CH3)所含的电子总数为8NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.苯分子中的碳碳键为一种介于碳碳单键和双键之间的独特键,不存在碳碳双键;
B.乙烯、聚丙烯、丙烯的最简式为CH2,根据最简式计算出混合物中含有的碳原子数目;
C.标准状况下,戊烷为液体,不能使用标况下的气体摩尔体积计算其物质的量;
D.甲基中含有9个电子,1mol甲基中含有9mol电子.
B.乙烯、聚丙烯、丙烯的最简式为CH2,根据最简式计算出混合物中含有的碳原子数目;
C.标准状况下,戊烷为液体,不能使用标况下的气体摩尔体积计算其物质的量;
D.甲基中含有9个电子,1mol甲基中含有9mol电子.
解答:
解:A.苯分子中的碳碳键为一种独特键,不存在碳碳双键,故A错误;
B.2.8g乙烯、丙烯和聚乙烯的混合物中含有0.2mol最简式CH2,含有0.2mol碳原子,混合物中所含碳原子数为0.2NA,故B正确;
C.标况下,戊烷不是气体,题中条件无法计算2.24L戊烷的物质的量,故C错误;
D.1mol甲基中含有9mol电子,所含的电子总数为9NA,故D错误;
故选B.
B.2.8g乙烯、丙烯和聚乙烯的混合物中含有0.2mol最简式CH2,含有0.2mol碳原子,混合物中所含碳原子数为0.2NA,故B正确;
C.标况下,戊烷不是气体,题中条件无法计算2.24L戊烷的物质的量,故C错误;
D.1mol甲基中含有9mol电子,所含的电子总数为9NA,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意标况下戊烷、乙醇、水等的状态不是气体,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确羟基与氢氧根离子、甲基与甲烷中含有的电子数.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、4.6 g组成为C2H6O的有机物,所含C-H键数目一定为0.6NA | ||||
| B、8.7 g MnO2与40 mL 10 mol?L-1的浓盐酸充分反应,生成的氯气分子数为0.1NA | ||||
| C、1 mol Na2O中含有的阴、阳离子总数是3NA而1 mol Na2O2中含有的阴、阳离子总数是4NA | ||||
D、在反应5NH4NO3
|
我国某些地区曾发生用石蜡油等工业用油加工大米的“毒米事件”,威胁人民健康.食用油和石蜡油虽然都称作“油”,但从化学组成和分子结构看,它们是完全不同的.下列说法正确的是( )
| A、食用油属于纯净物,石蜡油属于混合物 |
| B、食用油属于酯类,石蜡油属于烃类 |
| C、食用油属于有机物,石蜡油属于无机物 |
| D、食用油属于高分子化合物,石蜡油属于小分子 |
 图中曲线分别表示相同温度下,压强为P1、P2条件下发生可逆反应:mX(g)+nY(g)?2Z(g)+W(s)的过程.下列说法不正确的是( )
图中曲线分别表示相同温度下,压强为P1、P2条件下发生可逆反应:mX(g)+nY(g)?2Z(g)+W(s)的过程.下列说法不正确的是( )| A、P1>P2 |
| B、m+n=2 |
| C、m+n=3 |
| D、P1、P2下平衡常数相同 |
下列反应属于放热反应的是( )
| A、NaOH溶于水 | ||||
B、C+CO2
| ||||
| C、KClO3受热分解 | ||||
| D、Al与稀盐酸反应 |
对于质量相同的CH4和O2,下列说法正确的是( )
| A、所含分子个数相等 |
| B、物质的量相等 |
| C、所含原子个数之比为5:1 |
| D、体积之比为2:1 |
下列说法中正确的是( )
| A、对垃圾进行分类要严格执行国际统一的标准 |
| B、对垃圾进行分类的主要目的是便于垃圾的存放 |
| C、凡是废纸都可以归为纸类垃圾进行回收 |
| D、学生在课堂上用过的废纸可以积攒起来进行回收利用 |
苯和甲苯相比较,下列叙述中不正确的是( )
| A、都属于芳香烃 |
| B、都能在空气中燃烧 |
| C、都能使KMnO4酸性溶液褪色 |
| D、都能发生取代反应 |
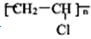 )就是以乙炔为原材料制得的.写出以乙炔和HCl为原料制聚氯乙烯的化学方程式.
)就是以乙炔为原材料制得的.写出以乙炔和HCl为原料制聚氯乙烯的化学方程式.