题目内容
三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2.其反应原理为:C3N3(OH)3
3HNCO; 8HNCO+6NO2
7N2+8CO2+4H2O下列说法正确的是( )
| ||
| ||
| A、C3N3(OH)3与HNCO为同一物质 |
| B、HNCO是一种很强的氧化剂 |
| C、1 mol NO2在反应中转移的电子为24 mol |
| D、反应中N2既是氧化产物又是还原产物 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:HCNO中,C元素化合价为+4价,N为-3价,在反应8HNCO+6NO2
7N2+8CO2+4H2O中,只有N元素化合价发生变化,HNCO为还原剂,NO2为氧化剂,结合化合价的变化计算转移电子的数目.
| ||
解答:
解:A.C3N3(OH)3与HNCO的组成和结构都不同,为不同物质,故A错误;
B.HCNO中,N元素化合价为-3价,处于最低价态,具有还原性,为还原剂,故B错误;
C.由反应8HNCO+6NO2
7N2+8CO2+4H2O可知,反应中NO2的N元素化合价由+4价降低到0价,则1mol NO2在反应中转移的电子为4mol,故C错误;
D.只有N元素化合价发生变化,HNCO为还原剂,NO2为氧化剂,N2既是氧化产物又是还原产物,故D正确.
故选D.
B.HCNO中,N元素化合价为-3价,处于最低价态,具有还原性,为还原剂,故B错误;
C.由反应8HNCO+6NO2
| ||
D.只有N元素化合价发生变化,HNCO为还原剂,NO2为氧化剂,N2既是氧化产物又是还原产物,故D正确.
故选D.
点评:本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识相关概念并把握物质的性质,题目难度不大.

练习册系列答案
相关题目
有A、B、C、D四种非金属元素:A、B在反应中各结合1个电子,形成稳定的结构,且B-的还原性小于A-的还原性;氢化物稳定性HD<HA;原子序数C<D,且C、D的稳定结构的核外电子数相等.则这四种元素非金属金属由强到弱的排列顺序是( )
| A、A、B、C、D |
| B、B、A、C、D |
| C、A、B、D、C |
| D、B、A、D、C |
可溶性化合物A、B、C由下表中离子组合而成(每种离子只存在于一种化合物中).
现将等物质的量的A、B、C一起溶于水后,所得混合溶液中除H+、OH-外还含有五离子.则A的化学式不可能是( )
| 阳离子 | Mg2+、Ag+、Na+ |
| 阴离子 | NO3-、SO42-、Cl- |
| A、AgNO3 |
| B、Na2SO4 |
| C、MgCl2 |
| D、MgSO4 |
下列用来表示物质变化的化学用语中,正确的是( )
| A、NH4NO3溶液呈酸性的原因:NH4++H2O=NH3?H2O+H+ |
| B、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ |
| C、硫酸氢钠溶液中滴加少量Ba(OH)2溶液的离子方程式:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ |
D、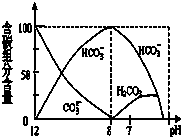 如图是在0.1 mol?L-1Na2CO3溶液中逐滴加入0.1 mol?L-1 HCl,则 pH=7时的离子方程式:H++HCO3-=CO2↑+H2O |
将等物质的量浓度的AlCl3和NaOH两溶液混和,得到的沉淀物中的铝元素与溶液中的铝元素的物质的量相等,则所用AlCl3溶液和NaOH溶液的体积之比可能是( )
| A、1:3 | B、2:3 |
| C、1:4 | D、2:5 |
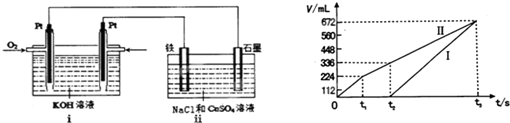
 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入Fe粉,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如如图所示.则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入Fe粉,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如如图所示.则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )| A、1:1:1 |
| B、1:1:4 |
| C、1:2:2 |
| D、3:2:8 |
对于同位素的概念,下列叙述中正确的是( )
| A、原子序数相等,化学性质与质量数不同 |
| B、原子序数相等,并有相同的化学性质和相同的质量数 |
| C、原子序数相等,化学性质几乎完全相同,而中子数不同 |
| D、化学性质相同,而质量数与原子序数不同 |