题目内容
19.下列说法正确的是( )| A. | N-H键键能的含义是把1molNH3中的共价键全部拆开所吸收的能量 | |
| B. | ClO-的空间构型为平面三角形 | |
| C. | 卤素单质从F2到I2,在常温常压下的聚集状态由气态、液态到固态的原因是原子半径逐渐增大 | |
| D. | 熔点由高到低的顺序为:金刚石>MgO>NaCl>CCl4 |
分析 A.键能是指生成(或拆开)1mol化学键释放(或吸收)的能量;
B.次氯酸根离子中O原子价层电子对个数是4且含有2个孤电子对,根据价层电子对互斥理论判断空间构型;
C.分子晶体的聚集状态与分子间作用力有关,结构相似的分子晶体相对分子质量越大,分子间作用力越大;
D.一般来说,晶体熔沸点:原子晶体>离子晶体>分子晶体,离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比,与电荷成正比.
解答 解:A.键能是指生成(或拆开)1mol化学键释放(或吸收)的能量,1mol氨气分子中含有3molN-H键,所以N-H键键能的含义是把NH3中1mol N-H键全部拆开所吸收的能量,故A错误;
B.次氯酸根离子中O原子价层电子对个数是4且含有3个孤电子对,根据价层电子对互斥理论判断空间构型为直线形,故B错误;
C.F2到I2在常温常压下的聚集状态的改变原因是分子间作用力的改变,结构相似的分子晶体相对分子质量越大,分子间作用力越大,所以卤素单质从F2到I2在常温常压下的聚集状态由气态、液态到固态,故C错误;
D.一般来说,晶体熔沸点:原子晶体>离子晶体>分子晶体,离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比,与电荷成正比,金刚石是原子晶体、MgO和NaCl是离子晶体、四氯化碳是分子晶体,且晶格能MgO>NaCl,所以熔点由高到低的顺序为:金刚石>MgO>NaCl>CCl4,故D正确;
故选D.
点评 本题考查较综合,涉及晶体熔沸点高低判断、分子间作用力、微粒空间构型判断、键能等知识点,侧重考查学生分析判断能力,为高频考点,注意晶格能大小比较方法、微粒空间构型判断方法,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
9.黄酮类化合物具有抗肿瘤活性,如图为合成中间体之一,下列有关该物质的说法正确的是( )
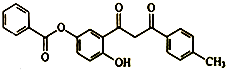

| A. | 分子中含醚键,不含手性碳原子 | |
| B. | 在空气中易被氧化变质 | |
| C. | 能发生取代、加成、消去反应 | |
| D. | 1mol该物质最多能与3mol NaOH溶液发生反应 |
10.下列反应的离子方程正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 碳酸钠溶液中加入足量盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
14.生活中常会碰到某些化学问题,如:
①“白雪牌”漂粉精可令所有有色物质黯然失“色”,没有最白,只有更白
②霸王洗发液不含任何化学物质
③夏天混用不同品牌的墨水书写时,钢笔的笔尖容易发生堵塞是因为胶体发生了聚沉的原因
④53度白酒是指该白酒的着火点是53℃
⑤太太口服液含丰富的氮、磷、锌等微量元素.
则有关上述说法,你的看法是( )
①“白雪牌”漂粉精可令所有有色物质黯然失“色”,没有最白,只有更白
②霸王洗发液不含任何化学物质
③夏天混用不同品牌的墨水书写时,钢笔的笔尖容易发生堵塞是因为胶体发生了聚沉的原因
④53度白酒是指该白酒的着火点是53℃
⑤太太口服液含丰富的氮、磷、锌等微量元素.
则有关上述说法,你的看法是( )
| A. | 全部正确 | B. | 只有①⑤正确 | ||
| C. | 只有③正确 | D. | 以上说法都是错误的 |
4.下列有关燃料电池的说法正确的是( )
| A. | 氢氧燃料电池可将热能直接转变为电能 | |
| B. | 燃料电池的能量转化率可达100% | |
| C. | 燃料电池与干电池或蓄电池的主要差别在于反应物不是储存在电池内部,而是由外设装备提供燃料和氧化剂 | |
| D. | 氢氧燃料电池工作时氢气在正极被氧化 |
11.下列表示对应化学反应的离子方程式正确的是( )
| A. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ | |
| C. | 0.01 mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
8.短周期主族元素X、Y、Z、W的原子序数依次增大,其中X是组成有机物的基本骨架元素,元素Y的核电荷数等于W原子的最外层电子数,元素Z的最高正化合价为+2价.下列说法正确的是( )
| A. | X的氢化物沸点大于Y的氢化物沸点 | |
| B. | Z在Y中燃烧生成的化合物中既含有离子键,又含有共价键 | |
| C. | 原子半径由大到小的顺序:X、Y、Z | |
| D. | 最高价氧化物对应水化物的酸性由强到弱的顺序:W、Y、X |
11.pH值相等的盐酸(甲)和醋酸(乙),分别与一定量的锌反应,若最后锌已全部溶解且放出气体一样多,为此下列说法正确的是( )
| A. | 反应开始时的速率:甲<乙 | |
| B. | 反应开始时,酸的物质的量浓度:甲>乙 | |
| C. | 反应开始时,酸的物质的量浓度:甲<乙 | |
| D. | 反应所需时间:甲<乙 |