题目内容
 K3[Fe(CN)6]铁氰化钾,别名赤血盐,深红色或红色单斜晶系柱状结晶或粉未,有剧毒.遇亚铁盐生成蓝色沉淀.结合下图判断,下列叙述正确的是( )
K3[Fe(CN)6]铁氰化钾,别名赤血盐,深红色或红色单斜晶系柱状结晶或粉未,有剧毒.遇亚铁盐生成蓝色沉淀.结合下图判断,下列叙述正确的是( )| A、Ⅰ和Ⅱ中负极反应均是Fe-2e-═Fe2+ |
| B、Ⅰ和Ⅱ中正极均被保护 |
| C、Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-═4OH- |
| D、Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:I中Zn失电子作负极,Fe作正极,正极上氧气得电子生成氢氧根离子;
II中Fe失电子作负极,Cu作正极,正极上氢离子得电子生成氢气,结合选项分析.
II中Fe失电子作负极,Cu作正极,正极上氢离子得电子生成氢气,结合选项分析.
解答:
解:A、I中Zn失电子作负极,负极反应为Zn-2e-═Zn2+,II中Fe失电子作负极,负极反应为Fe-2e-═Fe2+,故A错误;
B、原电池中正极上电极材料不参与反应,所以Ⅰ和Ⅱ中正极均被保护,故B正确;
C、I中正极上氧气得电子生成氢氧根离子,II中正极上氢离子得电子生成氢气,则正极上的反应不同,故C错误;
D、I中没有亚铁离子,加少量K3[Fe(CN)6]溶液无明显现象,II中Fe失电子作负极生成Fe2+,加少量K3[Fe(CN)6]溶液,有蓝色沉淀,故D错误;
故选B.
B、原电池中正极上电极材料不参与反应,所以Ⅰ和Ⅱ中正极均被保护,故B正确;
C、I中正极上氧气得电子生成氢氧根离子,II中正极上氢离子得电子生成氢气,则正极上的反应不同,故C错误;
D、I中没有亚铁离子,加少量K3[Fe(CN)6]溶液无明显现象,II中Fe失电子作负极生成Fe2+,加少量K3[Fe(CN)6]溶液,有蓝色沉淀,故D错误;
故选B.
点评:本题考查了原电池原理的应用及亚铁离子的检验,题目难度不大,注意把握原电池中正负极的判断及电极方程式的书写.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、常温下,78 g Na2O2中含有的阴离子数是2NA |
| B、标准状况下,22.4LSO3的物质的量为1mol |
| C、常温常压下,22.4 L SO2和O2混合气体中含有的氧原子数是2 NA |
| D、铁铝混合物与一定量稀盐酸反应生成1 mol H2时,转移电子数是2 NA |
已知, ,某分子式为C11H16的含一个苯环的有机物,其被酸性高锰酸钾溶液氧化得到
,某分子式为C11H16的含一个苯环的有机物,其被酸性高锰酸钾溶液氧化得到 ,则该有机物可能的结构有( )
,则该有机物可能的结构有( )
 ,某分子式为C11H16的含一个苯环的有机物,其被酸性高锰酸钾溶液氧化得到
,某分子式为C11H16的含一个苯环的有机物,其被酸性高锰酸钾溶液氧化得到 ,则该有机物可能的结构有( )
,则该有机物可能的结构有( )| A、2种 | B、3种 | C、4种 | D、5种 |
美国宇航局在2012年再次登陆火星,新火星车体积更大、功能更全,旨在探寻火星土壤中是否存在有机物.已有资料表明:火星表面富含碳酸盐和硫酸盐;火星上的水以冰块和霜冻的形式存在于南北两极.下列叙述不正确的是( )
| A、碳酸盐、硫酸盐都是含氧酸盐 |
| B、空气是混合物,冰水混合物是纯净物 |
| C、硫酸盐一定易溶于水 |
| D、碳酸钠、硫酸钠均属于钠盐 |
NA表示阿伏加德罗常数的值,下列有关说法正确的是( )
| A、标准状况下,22.4 LCH4和CH3CH2OH的混合物所含分子数为NA |
| B、常温常压下,16 g14CH4所含中子数目为8 NA |
| C、0.2 mol的Na2O2和水完全反应转移的电子数为0.2 NA |
| D、0.1 L 3 mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
下列说法正确的是( )
| A、复分解反应中有的是氧化还原反应,有的不是氧化还原反应 |
| B、置换反应有可能是非氧化还原反应 |
| C、化合反应一定是氧化还原反应 |
| D、分解反应不一定是氧化还原反应 |
下列变化过程中.所需克服的作用力均相同的是( )
| A、水气化 氯化钠熔化 |
| B、一冰升华 加热氯化按 |
| C、过氧化氢加入二氧化锰制氧气 碘化氢气体受热分解 |
| D、大理石高温生成二氧化碳.碘晶体升华为碘蒸气 |
消毒剂在日常生活、医疗、卫生、防疫中都有重要的作用,下列消毒剂的使用不正确的是( )
| A、过氧乙酸、漂白精是常用的消毒液 |
| B、食品加工、消毒防腐常使用福尔马林 |
| C、因患禽流感而被隔离的地区,常用生石灰处理 |
| D、医疗上常用75%的酒精进行消毒 |
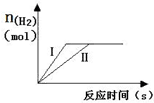 如图表示相同质量的Mg、Al分别跟一定量的稀H2SO4溶液反应的情况,下列叙述可能符合图示的是( )
如图表示相同质量的Mg、Al分别跟一定量的稀H2SO4溶液反应的情况,下列叙述可能符合图示的是( )| A、Mg、Al均不足,H2SO4过量 |
| B、消耗稀H2SO4的量是Ⅱ大于Ⅰ |
| C、Ⅰ表示Mg与稀H2SO4反应 |
| D、产生H2的速率是Ⅱ大于Ⅰ |