题目内容
3.(1)相同温度下,0.1mol/L下列溶液PH值由大到小的顺序是⑤>①>③>②>④①CH3COONa ②NH4Cl ③Na2SO4④NaHSO4⑤NH3•H2O
(2)室温下,向0.01mol/L NH4HSO4溶液中滴加NaOH溶液至中性,则溶液中阴阳离子
由大到小的顺序为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
分析 (1)根据溶液的酸碱性以及利用盐类的水解程度来确定溶液中pH大小,如:①碱性溶液的pH>、酸性溶液的pH<7,中性溶液的pH=7;②酸的酸性越弱则酸的酸根离子水解程度越大,其相同浓度钠盐溶液的pH越大,据此进行判断;
(2)向 NH4HSO4中滴加NaOH溶液,当二者物质的量相同时,溶质为等物质的量的(NH4)2SO4和Na2SO4,溶液呈酸性,再滴加少许NaOH呈中性.
解答 解:(1)①CH3COONa是强碱弱酸盐,其溶液呈碱性,pH>7;
②NH4Cl强酸弱碱盐,铵根离子水解而使其溶液呈弱酸性,pH<7;
③Na2SO4是强酸强碱盐,其溶液呈中性,pH=7;
④NaHSO4是强酸酸式盐,硫酸氢根离子能完全电离生成氢离子,导致其溶液呈强酸性,其酸性比硝酸铵强,即pH比硝酸铵小;
⑤NH3•H2O是弱碱,其溶液呈碱性,pH>7,相同物质的量浓度时,其碱性比NaClO强,即其pH比NaClO大;
所以这几种溶液pH大小顺序是⑤>①>③>②>④.
故答案为:⑤>①>③>②>④;
(2)NH4HSO4中滴加NaOH溶液,若二者物质的量相同时,溶质为等物质的量的(NH4)2SO 4和Na2SO 4,溶液呈酸性,需要再滴加少许NaOH呈中性,c(Na+)+c(NH4+)=2c(SO42-),故溶液中离子浓度大小关系为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
点评 本题考查了pH大小的判断,题目难度不大,先根据溶液的酸碱盐大体分类,再根据弱离子的水解浓度判断pH大小,注意硫酸氢根离子和碳酸氢根离子在水溶液里电离方式不同,为易错点.

练习册系列答案
相关题目
14.下列能级能量最高的是( )
| A. | 5s | B. | 2p | C. | 3d | D. | 4s |
18.如图实验装置一般不用于分离物质的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
8.酸性锌锰干电池和碱性锌锰干电池的构造简图如下所示,比较二者的异同,回答问题
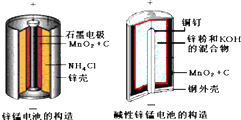
(1)酸性锌锰干电池的负极反应为Zn-2e-=Zn2+
(2)碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式MnO2+e-+H2O=MnOOH+OH-.
(3)维持电流强度为0.6A,电池工作10分钟,理论消耗Zn0.12g.(结果保留到小数点后两位,F=96500C/mol)
(4)用回收分离出的锌皮制作七水合硫酸锌,需去除少量杂质铁,除杂步骤如下:
①加入足量稀硫酸和双氧水溶液将锌皮溶解,此时锌离子浓度为0.1mol/L
②调节溶液的pH为2.7到6之间(结果保留到小数点后一位),过滤除去含铁元素的沉淀.

| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(2)碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式MnO2+e-+H2O=MnOOH+OH-.
(3)维持电流强度为0.6A,电池工作10分钟,理论消耗Zn0.12g.(结果保留到小数点后两位,F=96500C/mol)
(4)用回收分离出的锌皮制作七水合硫酸锌,需去除少量杂质铁,除杂步骤如下:
①加入足量稀硫酸和双氧水溶液将锌皮溶解,此时锌离子浓度为0.1mol/L
②调节溶液的pH为2.7到6之间(结果保留到小数点后一位),过滤除去含铁元素的沉淀.
15.下列反应的离子方程式书写正确的是( )
| A. | 氯水滴入氯化亚铁溶液中:Fe2++Cl2═Fe3++2Cl- | |
| B. | 钠投入硫酸铜溶液中:2Na+Cu2+═2Na++Cu | |
| C. | Al2O3与NaOH溶液的反应:Al2O3+2OH-═2AlO2-+H2O | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
12.下列说法不正确的是( )
| A. | 铝制品经久耐用的原因是在空气中其表面可形成致密的氧化膜 | |
| B. | Na-K合金可用于原子反应堆的导热剂 | |
| C. | 漂白粉可敞口保存 | |
| D. | AgI可用于人工降雨 |
13.化学与生活、科学、技术、社会、环境密切相关,下列有关说法中错误的是( )
| A. | 高纯硅可作计算机芯片的材料 | |
| B. | 洁厕灵的主要成分是盐酸,不能与“84”消毒液(主要成分是NaClO)混用 | |
| C. | PM2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 | |
| D. | Na2SiO3溶液可做木材防火剂 |