题目内容
20.下列各物质的分类、名称(或俗名)、化学式都正确的是( )| A. | 碱性氧化物 氢氧化钙 Ca(OH)2 | B. | 酸性氧化物 二氧化碳 CO2 | ||
| C. | 酸 硫酸 H2S | D. | 盐 烧碱 Na2CO3 |
分析 A.和酸反应生成盐和水的氧化物为碱性氧化物;
B.和碱反应生成盐和水的氧化物为酸性氧化物;
C.水溶液中电离出的阳离子全部是氢离子的化合物为酸;
D.金属阳离子和酸根阴离子构成的化合物为盐.
解答 解:A.氢氧化钙为碱不是碱性氧化物,故A错误;
B.二氧化碳和碱反应生成盐和水属于酸性氧化物,故B正确;
C.硫酸水溶液中电离出的阳离子全部是氢离子属于酸,化学式H2SO4,故C错误;
D.烧碱为氢氧化钠属于碱,碳酸钠为纯碱属于盐,故D错误;
故选B.
点评 本题考查了物质分类、物质组成和名称、注意知识的积累,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
10.已知卤代烃可以和钠发生反应,例如溴乙烷与钠发生反应为:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr
利用这一反应,下列所给化合物中可以与钠反应合成环丁烷的是( )
①CH3Br ②CH2BrCH2CH2CH2Br ③CH2BrCH2Br ④CH3CH2CH2CH2Br ⑤CH3CH2BrCHCH2Br.
利用这一反应,下列所给化合物中可以与钠反应合成环丁烷的是( )
①CH3Br ②CH2BrCH2CH2CH2Br ③CH2BrCH2Br ④CH3CH2CH2CH2Br ⑤CH3CH2BrCHCH2Br.
| A. | ①③⑤ | B. | ①④⑤ | C. | ②③ | D. | ①②③④⑤ |
11.在同温同压下,下列各组热化学方程式中,△H2>△H1 的是( )
| A. | 2H2(g)+O2(g)═2H2O(g)△H1 2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2 | |
| D. | 2HCl(g)═H2(g)+Cl2(g)△H1 H2(g)+Cl2(g)═2HCl(g)△H2 |
8.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO-与Cl-的浓度之比为1:6,则Cl2与NaOH溶液反应时被还原的氯与被氧化的氯的物质的量之比为( )
| A. | 21:5 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
15.下列状态的物质,既能导电又属于电解质的是( )
| A. | 液态氯化氢 | B. | 浓硫酸 | C. | 熔融的KOH | D. | MgCl2晶体 |
5.使用单质铜制取硝酸铜,最适宜的方法是( )
| A. | Cu+稀HNO3 | B. | Cu$\stackrel{空气、△}{→}$CuO$\stackrel{硝酸}{→}$Cu(NO3)2 | ||
| C. | Cu+浓HNO3 | D. | Cu$\stackrel{Cl_{2}}{→}$CuCl2 $\stackrel{AgNO_{3}}{→}$ Cu(NO3)2 |
12.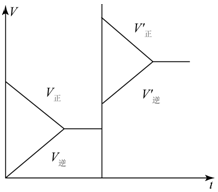 对于达平衡的可逆反应X+Y?W+Z,增大压强则正、逆反应速度(v)的变化如图,分析可知X、Y、Z,W的聚集状态可能是( )
对于达平衡的可逆反应X+Y?W+Z,增大压强则正、逆反应速度(v)的变化如图,分析可知X、Y、Z,W的聚集状态可能是( )
 对于达平衡的可逆反应X+Y?W+Z,增大压强则正、逆反应速度(v)的变化如图,分析可知X、Y、Z,W的聚集状态可能是( )
对于达平衡的可逆反应X+Y?W+Z,增大压强则正、逆反应速度(v)的变化如图,分析可知X、Y、Z,W的聚集状态可能是( )| A. | Z、W为气体,X、Y中之一为气体 | B. | X、Y中之一为气体,Z、W为非气体 | ||
| C. | X、Y、Z、W皆为气体 | D. | X、Y为气体,Z、W中之一为气体 |
1.亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上.某学习小组针对亚硝酸钠设计了如下实验:
【实验I】制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2;2NO2+Na2O2═2NaNO3
设计制备装置如下(夹持装置略去):
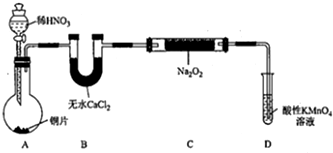
(1)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(2)如果没有B装置,C中发生的副反应有2Na2O2+2H2O=4NaOH+O2↑、2NO+O2=2NO2.
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质.于是在A、B装置增加了在A、B之间增加装有水的洗气瓶装置,改进后提高了NaNO2的纯度.
【实验Ⅱ】测定制取的样品中NaNO2的含量
步骤:
a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL并振荡,制成标准色阶:
b.分别称量0.10g制得的样品溶于水配成500mL溶液.取5mL待测液,加入1mL M溶液,再加蒸馏水至10mL振荡,与标准色阶比较.
(4)步骤b中比较结果是:待测液颜色与③号色阶相同,则甲同学制得的样品中NaNO2的质量分数是40%.
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量.设计并完成下列实验报告.
【实验I】制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2;2NO2+Na2O2═2NaNO3
设计制备装置如下(夹持装置略去):

(1)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(2)如果没有B装置,C中发生的副反应有2Na2O2+2H2O=4NaOH+O2↑、2NO+O2=2NO2.
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质.于是在A、B装置增加了在A、B之间增加装有水的洗气瓶装置,改进后提高了NaNO2的纯度.
【实验Ⅱ】测定制取的样品中NaNO2的含量
步骤:
a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL并振荡,制成标准色阶:
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
(4)步骤b中比较结果是:待测液颜色与③号色阶相同,则甲同学制得的样品中NaNO2的质量分数是40%.
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量.设计并完成下列实验报告.
| 实验方案 | 实验现象 | 实验结论 |
| 取5ml待测液加入维生素C,振荡,再加入1mlM溶液,加入至蒸馏水10mL,再振荡,与③好色阶对比 | 紫红色比③色阶浅 | 维生素C可以有效降低NaNO2的含量 |
2.下列依据相关实验得出的结论,正确的是( )
| A. | 用干净的铂丝蘸取少量溶液在酒精灯外焰上灼烧,发现火焰呈黄色,则溶液中无K+ | |
| B. | 检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液 | |
| C. | 向某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- | |
| D. | 向某溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀,则X中含有SO42- |