题目内容
1.已知铜在常温下能被稀HNO3溶解:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O(1)请将上述反应改写成离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(2)上述反应中氧化剂是HNO3,氧化产物是Cu(NO3)2,在该反应中,没有参加氧化还原反应的硝酸与总硝酸的物质的量之比为3:4.
分析 (1)在离子反应方程式中单质、气体、水应保留化学式;
(2)反应物中含元素化合价降低的物质为氧化剂,化合价升高的为氧化产物,结合元素化合价的变化解答.
解答 解:(1)反应3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O中,Cu、NO、H2O在改写成离子反应时保留化学式,则离子反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)反应物HNO3中N元素的化合价由+5价降低为+2价,则HNO3为氧化剂,Cu元素化合价升高,被氧化,Cu(NO3)2为氧化产物,由方程式可知在该反应中,没有参加氧化还原反应的硝酸与总硝酸的物质的量之比为 3:4,
故答案为:HNO3;Cu(NO3)2;3:4
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,明确离子方程式中哪些物质的化学式应保留及反应中元素的化合价变化即可解答,难度不大.

练习册系列答案
相关题目
9.如表给出了各个化学键的键能数据:
下列分子中,最稳定的是( )
| 化学键 | H-H | H-Cl | H-I | Cl-Cl | Br-Br |
| 键能/kj•mol-1 | 436 | 431 | 299 | 243 | 194 |
| A. | Cl2 | B. | Br2 | C. | HCl | D. | H2 |
16.糖类、油脂和蛋白质都是人类必需的基本营养物质,下列有关说法中不正确的是( )
| A. | 糖类、油脂和蛋白质都能发生水解反应 | |
| B. | 淀粉、纤维素、蛋白质都属于天然有机高分子化合物 | |
| C. | 采用多次盐析和溶解,可以分离提纯蛋白质 | |
| D. | 一般情况下,天然油脂都可以发生加成反应 |
6.合成导电高分子材料PPV的反应:
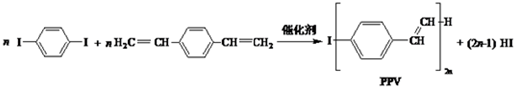
下列说法正确的是( )

下列说法正确的是( )
| A. | 合成PPV的反应为缩聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. | 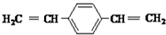 和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 通过红外光谱测定PPV的平均相对分子质量,可得其聚合度 |
13.Al,Fe都是重要的金属元素.下列说法正确的是( )
| A. | 铝能够稳定存在于空气中,而铁很容易生锈,说明铁比铝活泼 | |
| B. | 明矾(KAl (SO4)2•12H2O)可用于净水 | |
| C. | 二者对应的氧化物均为碱性氧化物 | |
| D. | Fe3O4是一种红棕色粉末,俗称磁性氧化铁 |
10.已知下面三个数据:7.2×10-4 mol•L-1、4.6×10-4 mol•L-1、4.9×10-10 mol•L-1分别是下列有关的三种酸的电离常数的数值,若已知下列反应可以发生:NaCN+HNO2═HCN+NaNO2;NaCN+HF═HCN+NaF;NaNO2+HF═HNO2+NaF,由此可判断下列叙述不正确的是( )
| A. | NaCN和HCN 1:1组成的溶液呈酸性 | |
| B. | 0.1mol•l-1的NaF、NaNO2、NaCN溶液的pH逐渐增大 | |
| C. | 根据两个反应即可得出这三种酸的电离常数数值 | |
| D. | K(HCN)<K(HNO2)<K(HF) |
11.X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如图所示.Z元素原子核外K层与M层电子数相等.下列说法中正确的是( )
| X | Y | ||
| Z | W |
| A. | 与同浓度的盐酸反应,Z比W更剧烈 | |
| B. | 原子半径由小到大的顺序为:X<Z<Y<W | |
| C. | Y元素最高价氧化物对应的水化物的化学式为H3YO4 | |
| D. | X、Z两种元素的氧化物中所含化学键类型相同 |
 .
. .
.