题目内容
 以下是一些物质的熔沸点数据(常压):
以下是一些物质的熔沸点数据(常压):| 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 | |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
4Na(g)+3CO2(g)?2Na2CO3(l)+C(s,金刚石)△H=-1080.9kJ/mol
(1)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min内CO2的平均反应速率为
(2)高压下有利于金刚石的制备,理由是
(3)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石)△H=-357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(l)的热化学方程式
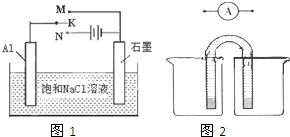
(4)如图1开关K接M时,石墨电极反应式为
(5)请运用原电池原理设计实验,验证Cu2+、Ag+氧化性的强弱.在方框内画出实验装置图2,要求用烧杯和盐桥(在同一烧杯中,电极与溶液含相同的金属元素),并标出外电路电子流向.
考点:原电池和电解池的工作原理,热化学方程式,反应速率的定量表示方法
专题:化学反应中的能量变化,化学反应速率专题,电化学专题
分析:(1)根据金属钠的物质的量的变化求CO2出的物质的量变化,再求出浓度变化和速率;
(2)根据压强对速率和平衡的影响分析;
(3)根据已知热化学方程式,结合盖斯定律计算书写;
(4)原电池中正极上氧气得电子生成氢氧根离子;
(5)Cu、Ag构成原电池时,Cu比Ag活泼,Cu作负极,Ag作正极.
(2)根据压强对速率和平衡的影响分析;
(3)根据已知热化学方程式,结合盖斯定律计算书写;
(4)原电池中正极上氧气得电子生成氢氧根离子;
(5)Cu、Ag构成原电池时,Cu比Ag活泼,Cu作负极,Ag作正极.
解答:
解:(1)反应时间为10min,金属钠的物质的量减少了0.2mol,则二氧化碳的物质的量减少为n(CO2)=
n(Na)=0.2mol×
=0.15mol,则10min内CO2的平均反应速率为v(CO2)=
=0.0015 mol/(L?min),
故答案为:0.0015 mol/(L?min);
(2)已知4Na(g)+3CO2(g)?2Na2CO3(l)+C(s,金刚石),该反应正方向为气体体积减小的方向,所以增大压强平衡正移,而且反应速率加快;
故答案为:增大压强加快反应速率,反应向正反应方向移动;
(3)已知:①4Na(g)+3CO2(g)?2Na2CO3(l)+C(s,金刚石)△H=-1080.9kJ/mol
②CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石)△H=-357.5kJ/mol
则由盖斯定律:①×
-②×
得 3Na2O(s)+C(s,金刚石)=4Na(g)+Na2CO3(l)△H=-4.2kJ/mol;
故答案为:3Na2O(s)+C(s,金刚石)=4Na(g)+Na2CO3(l)△H=-4.2kJ/mol;
(4)如图1开关K接M时,则形成原电池,原电池中正极上氧气得电子生成氢氧根离子,石墨电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(5)Cu、Ag构成原电池时,Cu比Ag活泼,Cu作负极,Ag作正极;Cu电极放入硫酸铜溶液,Ag电极放入硝酸银溶液,依此作图 ,
,
故答案为: .
.
| 3 |
| 4 |
| 3 |
| 4 |
| ||
| 10min |
故答案为:0.0015 mol/(L?min);
(2)已知4Na(g)+3CO2(g)?2Na2CO3(l)+C(s,金刚石),该反应正方向为气体体积减小的方向,所以增大压强平衡正移,而且反应速率加快;
故答案为:增大压强加快反应速率,反应向正反应方向移动;
(3)已知:①4Na(g)+3CO2(g)?2Na2CO3(l)+C(s,金刚石)△H=-1080.9kJ/mol
②CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石)△H=-357.5kJ/mol
则由盖斯定律:①×
| 1 |
| 2 |
| 3 |
| 2 |
故答案为:3Na2O(s)+C(s,金刚石)=4Na(g)+Na2CO3(l)△H=-4.2kJ/mol;
(4)如图1开关K接M时,则形成原电池,原电池中正极上氧气得电子生成氢氧根离子,石墨电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(5)Cu、Ag构成原电池时,Cu比Ag活泼,Cu作负极,Ag作正极;Cu电极放入硫酸铜溶液,Ag电极放入硝酸银溶液,依此作图
 ,
,故答案为:
 .
.
点评:本题考查了反应速率的计算、影响速率和平衡的因素、盖斯定律的应用、原电池原理的应用等,题目涉及的知识点较多,侧重于反应原理的应用的考查,注意准确把握有关原理,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列离子方程式中,正确的是( )
| A、已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:ClO-+CO2+H2O=HClO+HCO3- |
| B、硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ |
| C、从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
| D、FeCl2溶液中滴加NaClO溶液生成红褐色沉淀:2Fe2++ClO-+5H2O=2Fe(OH) 3↓+Cl-+4H+ |
下列离子方程式表达正确的是( )
| A、等体积,等物质的量浓度的NaHCO3溶液和Ca(OH)2溶液混合:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| B、FeI2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl- |
| C、CH3COONH4的电离:CH3COONH4?NH4++CH3COO- |
| D、苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- |
结构简式为(CH3)3CCH2CH3的烷烃,与氯气发生取代反应后,生成的二氯代产物有( )(不考虑立体异构)
| A、6种 | B、7种 | C、8种 | D、9种 |



