题目内容
7.电解在工业生产中有广泛的应用,关于如图所示的电解示意图,下列说法不正确的是( )
| A. | 若为电解饱和食盐水的装置,则a,b上均产生气体 | |
| B. | 若为工业冶炼铝的装置,则用熔融氯化铝作电解液 | |
| C. | 若为工业制钠的装置,则钠在a上生成 | |
| D. | 若利用该装置回收氯化铜溶液中的铜,则a不能是铜 |
分析 由电流方向可知a为电解池的阳极,b为阴极,
A.电解饱和食盐水,阳极生成氯气,阴极生成氢气;
B.熔融氯化铝不导电;
C.工业用电解熔融的NaCl冶炼钠,钠在阴极生成;
D.利用该装置回收氯化铜溶液中的铜,阴极应为纯铜.
解答 解:由电流方向可知a为电解池的阳极,b为阴极,
A.电解饱和食盐水,阳极生成氯气,阴极生成氢气,a,b上均产生气体,故A正确;
B.熔融氯化铝不导电,应用电解氧化铝制备铝,故B错误;
C.工业用电解熔融的NaCl冶炼钠,阳极生成氯气,钠在阴极生成,故C错误;
D.利用该装置回收氯化铜溶液中的铜,阴极应为纯铜,即b为铜,故D正确.
故选BC.
点评 本题考查电解知识,为高频考点,侧重于学生的分析能力的考查,注意把握电解池的工作原理,把握两极的变化以及电极反应,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.有A、B、C、D四种金属,将A与B用导线联结起来,浸入电解质溶液中,B不易腐蚀.将A、D分别投入等物质的量浓度盐酸中,D比A反应剧烈.将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
| A. | A>D>B>C | B. | D>A>B>C | C. | D>A>C>B | D. | C>B>A>D |
18.对Na、Mg、Al的有关性质的叙述正确的是( )
| A. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | B. | 原子半径:Na<Mg<Al | ||
| C. | 金属性:Na<Mg<Al | D. | 单质的还原性:Al>Mg>Na |
2.化学与生活、生产、环境密切相关,下列有关说法正确的是( )
| A. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| B. | 地沟油的主要成分和汽油、柴油相同,可以添加到汽油中做燃料 | |
| C. | K2FeO4和明矾都可做水处理剂,但工作原理不完全相同 | |
| D. | “水滴石穿”、“绳锯木断”的过程中都包含化学变化 |
7.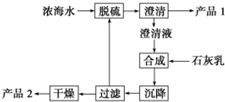 海水淡化及海水资源的提取利用是当今化工行业重要课题.
海水淡化及海水资源的提取利用是当今化工行业重要课题.
回答下列问题:
(1)下列属于海水淡化常见工艺的是①②③(填序号).
①电渗析法 ②蒸馏法
③离子交换法 ④沉淀法
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是 Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收1mol Br2 时,转移的电子为$\frac{5}{3}$mol.
(3)海水提镁的一段工艺流程如图,浓海水的主要成分如表:
该工艺过程中,脱硫阶段主要反应的离子方程式为Ca2++SO42-═CaSO4↓,产品2 的化学式为Mg(OH)2,1L 浓海水最多可得到产品2 的质量为69.6g.
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式:Mg+2H2O$\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑.
 海水淡化及海水资源的提取利用是当今化工行业重要课题.
海水淡化及海水资源的提取利用是当今化工行业重要课题.回答下列问题:
(1)下列属于海水淡化常见工艺的是①②③(填序号).
①电渗析法 ②蒸馏法
③离子交换法 ④沉淀法
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是 Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收1mol Br2 时,转移的电子为$\frac{5}{3}$mol.
(3)海水提镁的一段工艺流程如图,浓海水的主要成分如表:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式:Mg+2H2O$\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑.
8.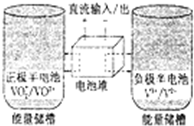 全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中.其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-═V3+,下列说法正确的是( )
全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中.其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-═V3+,下列说法正确的是( )
 全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中.其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-═V3+,下列说法正确的是( )
全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中.其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-═V3+,下列说法正确的是( )| A. | 放电时,右槽发生还原反应 | |
| B. | 放电时,左槽的电极反应式:VO2++2H++e-═VO2++H2O | |
| C. | 充电时,每转移1mol电子,n(H+)的变化量为1mol | |
| D. | 充电时,阴极电解液pH升高 |
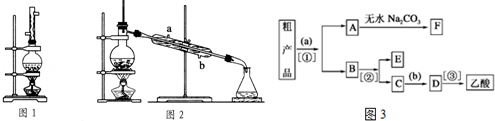
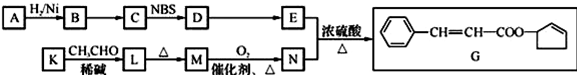
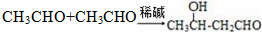
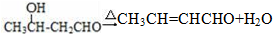
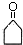 .
.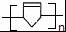 .
.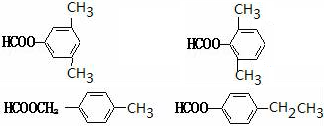 任意2种.
任意2种.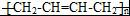 ).请设计合成路线(其他无机原料任选)并用如下方式表示:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物HOCH2CH2CH2CH3$→_{△}^{浓硫酸}$CH2=CHCH2CH3$\stackrel{NBS}{→}$CH2=CHCHBrCH3$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{催化剂}{→}$
).请设计合成路线(其他无机原料任选)并用如下方式表示:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物HOCH2CH2CH2CH3$→_{△}^{浓硫酸}$CH2=CHCH2CH3$\stackrel{NBS}{→}$CH2=CHCHBrCH3$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{催化剂}{→}$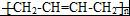 .
.