题目内容
下列说法正确的是( )
| A、凡有杂质的铜片放在稀硫酸中,较长时间后发现溶液变蓝色,说明Cu片发生了吸氧腐蚀 |
| B、反应H2S+H2SO4(浓)═S↓+SO2↑+2H2O中,生成物S是还原产物. |
| C、元素的非金属性强弱与其氢化物水溶液的酸性强弱相一致 |
| D、已知:P4(s)+6Cl2═4PCl3(g)△H=a KJ?mol-1 P4(s)+10Cl2(g)=4PCl5(g)△H=bKJ?mol-1 由此可求Cl2(g)+PCl3(g)═PCl5(s)的反应热△H |
考点:金属的电化学腐蚀与防护,非金属在元素周期表中的位置及其性质递变的规律,用盖斯定律进行有关反应热的计算,浓硫酸的性质
专题:
分析:A.凡有杂质的铜片放在稀硫酸中,较长时间后发现溶液变蓝色,说明Cu片失电子发生氧化反应,则正极上氧气得电子发生还原反应;
B.该反应中硫化氢中的S元素化合价由-2价变为0价,硫酸中S元素化合价由+6价变为+4价,所以硫酸是氧化剂、硫化氢是还原剂,氧化剂对应的产物是还原产物;
C.非金属越强的元素其氢化物的水溶液酸性不一定强;
D.根据盖斯定律计算.
B.该反应中硫化氢中的S元素化合价由-2价变为0价,硫酸中S元素化合价由+6价变为+4价,所以硫酸是氧化剂、硫化氢是还原剂,氧化剂对应的产物是还原产物;
C.非金属越强的元素其氢化物的水溶液酸性不一定强;
D.根据盖斯定律计算.
解答:
解:A.凡有杂质的铜片放在稀硫酸中,较长时间后发现溶液变蓝色,说明Cu片失电子发生氧化反应,则正极上氧气得电子发生还原反应,所以该Cu片发生吸氧腐蚀,故A正确;
B.该反应中硫化氢中的S元素化合价由-2价变为0价,硫酸中S元素化合价由+6价变为+4价,所以硫酸是氧化剂、硫化氢是还原剂,氧化剂对应的产物是还原产物,所以S是氧化产物,故B错误;
C.非金属越强的元素其氢化物的水溶液酸性不一定强,如相同浓度的HCl和HI,酸性HI>HCl,故C错误;
D.已知方程式中PCl5是气体、而未知方程式中PCl5是固体,所以不能进行计算,故D错误;
故选A.
B.该反应中硫化氢中的S元素化合价由-2价变为0价,硫酸中S元素化合价由+6价变为+4价,所以硫酸是氧化剂、硫化氢是还原剂,氧化剂对应的产物是还原产物,所以S是氧化产物,故B错误;
C.非金属越强的元素其氢化物的水溶液酸性不一定强,如相同浓度的HCl和HI,酸性HI>HCl,故C错误;
D.已知方程式中PCl5是气体、而未知方程式中PCl5是固体,所以不能进行计算,故D错误;
故选A.
点评:本题考查较综合,涉及盖斯定律、氧化还原反应、原电池原理等知识点,侧重考查学生对基本理论的理解和运用,易错选项是D,注意物质的状态,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
有①氨水、②NH4Cl溶液、③Na2CO3溶液、④NaHCO3溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
| A、4种溶液pH的大小顺序:①>④>③>② |
| B、溶液①、②等体积混合后pH>7,则c(NH4+)<c(NH3?H2O) |
| C、向溶液①、②中分别加入25 mL 0.1mol/L 盐酸后,溶液中c(NH4+):①>② |
| D、向溶液③、④中分别加入25mL 0.1mol/L NaOH溶液后,两溶液中的离子种类相同 |
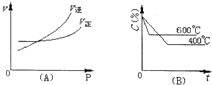 如图中C%表示某反应物在体系中的百分含量,图(A)为温度一定时压强与反应速度的关系曲线.图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )
如图中C%表示某反应物在体系中的百分含量,图(A)为温度一定时压强与反应速度的关系曲线.图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )| A、N2O3(g)?NO2(g)+NO(g)△H>0 |
| B、4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 |
| C、3NO2(g)+H2O(I)?2HNO3(I)+NO(g)△H<0 |
| D、CO2(g)+C(s)?2CO(g)△H>0 |
下列说法正确的是( )
| A、氢氧燃料电池的能量转换形式之一为化学能转化为电能 |
| B、铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| C、电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 |
| D、催化剂通过降低化学反应的焓变加快化学反应速率 |
下列各组离子在指定溶液中,一定能大量共存的是( )
| A、加入KSCN显红色的溶液中:Na+、Cu2+、Cl-、I- |
| B、c(CO32-)=0.1mol/L的溶液中:K+、Na+、Cl-、I- |
| C、c(H+)/c(OH-)=1012的溶液中:NH4+、Fe2+、NO3-、SO42- |
| D、甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ |
下列关于溶液和胶体的叙述,正确的是( )
| A、溶液呈电中性,胶体带电 |
| B、用一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
| C、溶液中的分散质粒子能透过滤纸,胶体中分散质粒子不能透过滤纸 |
| D、将FeCl3溶液滴加到沸水中,长时间加热煮沸就可制得Fe(OH)3 |
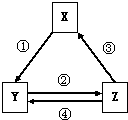 下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )