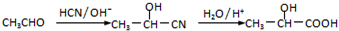题目内容
硫酸亚铁铵[(NH4)2Fe(SO4)2?6H2O]是分析化学中重要的试剂,常用于代替硫酸亚铁.
已知:硫酸亚铁铵在 500℃时隔绝空气加热完全分解,发生了氧化还原反应.
(1)固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和 (填写化学式)
实验:为检验分解产物的成份,设计如图所示的实验装置进行实验,加热A中的硫酸亚铁铵至分解完全.
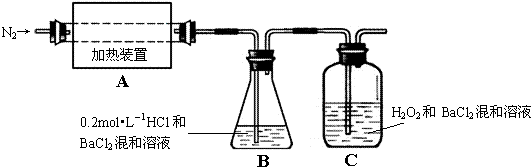
(2)A中固体充分加热较长时间后,通入氮气,目的是 .
(3)为验证A中残留物是否含有FeO,需要选用的试剂有 .
A.KSCN溶液 B.浓盐酸 C.KMnO4溶液 D.稀硫酸
(4)装置B中BaCl2溶液的作用是为了检验分解产物中是否有 气体生成,若含有该气体,观察到的现象为 .
(5)现欲将B中溶液准确稀释至100.00mL,应将锥形瓶中的溶液转移入 (填仪器名称)定容.实验中,观察到C中有白色沉淀生成,则C中发生的反应为 (用离子方程式表示).
已知:硫酸亚铁铵在 500℃时隔绝空气加热完全分解,发生了氧化还原反应.
(1)固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和
实验:为检验分解产物的成份,设计如图所示的实验装置进行实验,加热A中的硫酸亚铁铵至分解完全.

(2)A中固体充分加热较长时间后,通入氮气,目的是
(3)为验证A中残留物是否含有FeO,需要选用的试剂有
A.KSCN溶液 B.浓盐酸 C.KMnO4溶液 D.稀硫酸
(4)装置B中BaCl2溶液的作用是为了检验分解产物中是否有
(5)现欲将B中溶液准确稀释至100.00mL,应将锥形瓶中的溶液转移入
考点:性质实验方案的设计
专题:实验题
分析:(1)硫酸亚铁铵在 500℃时隔绝空气加热完全分解,发生了氧化还原反应,Fe元素生成FeO和Fe2O3,部分Fe元素失电子发生氧化反应,气体产物可能有NH3、SO3、H2O、N2,部分N元素失电子发生氧化反应,所以还有得电子的元素发生还原反应;
(2)通过氮气,使生成的气体完全被排出,从而充分被B、C装置吸收;
(3)FeO和酸反应生成亚铁离子,亚铁离子具有还原性,能被某些氧化剂氧化;
(4)SO3和水反应生成H2SO4,H2SO4和BaCl2反应生成白色沉淀BaSO4,二氧化硫和氯化钡不反应;
(5)实验室用容量瓶配制一定物质的量浓度的溶液;二氧化硫具有还原性,能被氧化性物质氧化.
(2)通过氮气,使生成的气体完全被排出,从而充分被B、C装置吸收;
(3)FeO和酸反应生成亚铁离子,亚铁离子具有还原性,能被某些氧化剂氧化;
(4)SO3和水反应生成H2SO4,H2SO4和BaCl2反应生成白色沉淀BaSO4,二氧化硫和氯化钡不反应;
(5)实验室用容量瓶配制一定物质的量浓度的溶液;二氧化硫具有还原性,能被氧化性物质氧化.
解答:
解:(1)硫酸亚铁铵在 500℃时隔绝空气加热完全分解,发生了氧化还原反应,Fe元素生成FeO和Fe2O3,部分Fe元素失电子发生氧化反应,气体产物可能有NH3、SO3、H2O、N2,部分N元素失电子发生氧化反应,所以还有得电子的元素发生还原反应,硫酸亚铁铵中S元素得电子发生还原反应,所以还生成SO2,故答案为:SO2;
(2)通过氮气,使生成的气体完全被排出,从而充分被B、C装置吸收,故答案为:使分解产生的气体在B、C中被吸收充分;
(3)FeO和酸反应生成亚铁离子,亚铁离子具有还原性,能被某些氧化剂氧化,一般用KMnO4溶液检验亚铁离子,但高锰酸钾能将浓盐酸氧化,所以应该用稀硫酸溶解FeO,故选CD;
(4)硫酸和HCl都是强酸,SO3和水反应生成H2SO4,H2SO4和BaCl2反应生成不溶于稀盐酸的白色沉淀BaSO4,导致溶液变浑浊,亚硫酸酸性小于HCl,所以SO2和BaCl2不反应,
故答案为:SO3;溶液变浑浊;
(5)实验室用100mL容量瓶配制该浓度的溶液,二氧化硫具有还原性,能被氧化性物质氧化,化学反应方程式为SO2+H2O2+Ba2+=BaSO4↓+2H+,
故答案为:100mL容量瓶;SO2+H2O2+Ba2+=BaSO4↓+2H+.
(2)通过氮气,使生成的气体完全被排出,从而充分被B、C装置吸收,故答案为:使分解产生的气体在B、C中被吸收充分;
(3)FeO和酸反应生成亚铁离子,亚铁离子具有还原性,能被某些氧化剂氧化,一般用KMnO4溶液检验亚铁离子,但高锰酸钾能将浓盐酸氧化,所以应该用稀硫酸溶解FeO,故选CD;
(4)硫酸和HCl都是强酸,SO3和水反应生成H2SO4,H2SO4和BaCl2反应生成不溶于稀盐酸的白色沉淀BaSO4,导致溶液变浑浊,亚硫酸酸性小于HCl,所以SO2和BaCl2不反应,
故答案为:SO3;溶液变浑浊;
(5)实验室用100mL容量瓶配制该浓度的溶液,二氧化硫具有还原性,能被氧化性物质氧化,化学反应方程式为SO2+H2O2+Ba2+=BaSO4↓+2H+,
故答案为:100mL容量瓶;SO2+H2O2+Ba2+=BaSO4↓+2H+.
点评:本题考查性质实验方案设计,明确物质的性质、实验原理是解本题关键,侧重考查学生分析问题、解答问题能力,熟练掌握元素化合物知识,题目难度不大.

练习册系列答案
相关题目
下列各组物质中,因为反应条件或用量不同而发生不同化学反应的是( )
①C与O2 ②Na与O2 ③Fe与Cl2 ④AlCl3溶液与NaOH溶液⑤CO2与NaOH溶液 ⑥Cu与硝酸.
①C与O2 ②Na与O2 ③Fe与Cl2 ④AlCl3溶液与NaOH溶液⑤CO2与NaOH溶液 ⑥Cu与硝酸.
| A、除③外 | B、除③⑤外 |
| C、除③④外 | D、除⑥外 |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | ||
| B、由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO3-、K+ | ||
C、
| ||
| D、c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、HCO3- |
NA为阿伏加德罗常数,下列叙述错误的是( )
| A、46 g NO2和N2O4混合气体中含有原子总数为3NA |
| B、常温下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应小于0.1NA |
| C、12 g金刚石中含有的共价键数为2NA |
| D、2.1 g DTO中所含中子数为NA |
下列关于改变条件对活化分子影响的说法错误的是( )
| A、温度不变时,增大反应物浓度可能增大活化分子的分子数 |
| B、其他条件不变时,升高温度能使分子获得更高的能量,活化分子百分数提高 |
| C、其他条件不变时,对于有气体参与和生成的反应而言,缩小体积增大体系的压强能增大单位体积内的活化分子百分数 |
| D、其他条件不变时,加人正催化剂能提高反应体系中含有的活化分子百分数 |