题目内容
NA为阿伏加德罗常数,下列叙述错误的是( )
| A、46 g NO2和N2O4混合气体中含有原子总数为3NA |
| B、常温下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应小于0.1NA |
| C、12 g金刚石中含有的共价键数为2NA |
| D、2.1 g DTO中所含中子数为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.NO2和N2O4的最简式相同为NO2,计算46g NO2中所含原子数;
B.常温下Vm>22.4L/mol,1.12 L H2的物质的量小于0.05mol;
C.金刚石中,每个C与其它4个C形成了四个共价键,根据均摊法计算出1molC含有的共价键;
D.D中含有1个中子,T中含有2个中子.
B.常温下Vm>22.4L/mol,1.12 L H2的物质的量小于0.05mol;
C.金刚石中,每个C与其它4个C形成了四个共价键,根据均摊法计算出1molC含有的共价键;
D.D中含有1个中子,T中含有2个中子.
解答:
解:A.NO2和N2O4的最简式相同为NO2,计算46g NO2中所含原子数=
×3×NA=3NA,故A正确;
B.常温下Vm>22.4L/mol,1.12 L H2的物质的量小于0.05mol,所以转移的电子数应小于0.1NA,故B正确;
C.12g金刚石中含有1molC,金刚石中,每个C与其它4个C形成了4个共价键,每个碳原子形成的共价键数目为:
×4=2,所以1molC原子形成的共价键为2mol,含有的共价键数目为2NA,故C正确;
D.D中含有1个中子,T中含有2个中子,2.1 g DTO的物质的量=
=0.1mol,含中子数为0.3NA,故D错误;
故选:D.
| 46g |
| 46g/mol |
B.常温下Vm>22.4L/mol,1.12 L H2的物质的量小于0.05mol,所以转移的电子数应小于0.1NA,故B正确;
C.12g金刚石中含有1molC,金刚石中,每个C与其它4个C形成了4个共价键,每个碳原子形成的共价键数目为:
| 1 |
| 2 |
D.D中含有1个中子,T中含有2个中子,2.1 g DTO的物质的量=
| 2.1g |
| 21g/mol |
故选:D.
点评:本题考查阿伏加德罗常数的综合应用,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确常见物质的空间结构及成键情况是解题关键,题目难度中等.

练习册系列答案
相关题目
下列分子式只能表示一种物质的是( )
| A、C3H6Cl2 |
| B、C3H8 |
| C、C2H6O |
| D、C8H10 |
下列物质在水溶液中的电离方程式正确的是( )
| A、Na2CO3=Na22++CO32- |
| B、NaHSO4=Na++H++SO42- |
| C、CH3COOH=H++CH3COO- |
| D、H2CO3=2H++CO32- |
某同学按图所示的装置进行电解实验.下列说法正确的是( )
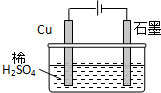

| A、电解过程中,铜电极上有H2产生 | ||||
| B、电解一定时间后,石墨电极上有H2析出 | ||||
| C、整个电解过程中,H+的浓度不断增大 | ||||
D、电解初期,主反应方程式为:Cu+H2SO4
|
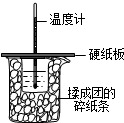 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: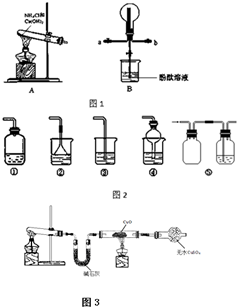 某化学实验小组同学利用如图1所示装置制备氨气,并探究氨气的性质(部分仪器已略去).
某化学实验小组同学利用如图1所示装置制备氨气,并探究氨气的性质(部分仪器已略去).