题目内容
在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,还原剂是 ,若消耗19.2g还原剂,则被还原的氧化剂是 mol,HNO3表现 和 .
考点:氧化还原反应
专题:氧化还原反应专题
分析:8HNO3+3Cu═3Cu(NO3)2+2NO↑+4H2O反应中,Cu元素的化合价由0升高为+2价,N元素的化合价由+5价降低为+2价,以此来解答.
解答:
解:8HNO3+3Cu═3Cu(NO3)2+2NO↑+4H2O反应中,Cu元素的化合价升高,则Cu为还原剂,被氧化,对应的Cu(NO3)2为氧化产物;N元素的化合价降低,则HNO3为氧化剂,被还原,则NO为还原产物,
n(Cu)=
=0.3mol,由方程式可知当3molCu参加反应时,有2mol硝酸被还原,则0.3molCu参加反应,被还原的硝酸为0.2mol,反应中硝酸表现为氧化性和酸性.
故答案为:Cu;0.2;酸性;氧化性.
n(Cu)=
| 19.2g |
| 64g/mol |
故答案为:Cu;0.2;酸性;氧化性.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意从元素化合价角度分析,题目难度不大.

练习册系列答案
相关题目
国际巴黎车展示上,世界各大汽车商纷纷推出环保动力小汽车,使用的新型环保电池为( )
| A、氢氧燃料电池 | B、锌锰电池 |
| C、镍镉电池 | D、铅蓄电池 |
实验中需1mol/L的NaOH溶液950mL,配制时应选用的容量瓶的规格和称取NaOH的质量分别是( )
| A、1000mL,38.0g |
| B、1000mL,40.0g |
| C、任意规格,38.0g |
| D、500mL,20.0g |
下列分子式只能表示一种物质的是( )
| A、C3H6Cl2 |
| B、C3H8 |
| C、C2H6O |
| D、C8H10 |
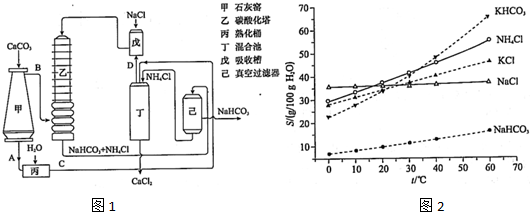
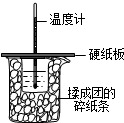 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: