题目内容
4.(1)配制500mL 0.2mol/LNaOH溶液需要的NaOH质量是多少?(2)取上述溶液20mL稀释成100mL后其物质的量浓度是多少?
分析 (1)结合m=nM、n=cV计算;
(2)稀释前后溶质的物质的量不变,以此计算.
解答 解:(1)配制500mL 0.2mol/LNaOH溶液需要的NaOH质量是0.5L×0.2mol/L×40g/mol=4 g,
答:配制500mL 0.2mol/LNaOH溶液需要的NaOH质量是4g;
(2)稀释前后溶质的物质的量不变,则上述溶液20mL稀释成100mL后其物质的量浓度是$\frac{0.02L×0.2mol/L}{0.1L}$=0.04mol/L,
答:上述溶液20mL稀释成100mL后其物质的量浓度是0.04 mol/L.
点评 本题考查一定物质的量浓度的溶液配制及计算,为高频考点,把握质量、浓度、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意稀释前后溶质的物质的量不变,题目难度不大.

练习册系列答案
相关题目
14.下列用来表示物质变化的化学用语中,正确的是( )
| A. | 钢铁发生电化腐蚀的正极反应式:Fe-2e-═Fe2+ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ |
15.下列实验现象与对应化学(或离子)方程式都正确的是( )
| A. | 金属钠投入水中,浮在水面熔成小球,并在水面快速移动,得到的溶液显碱性;Na+H2O═Na++OH-+H2↑ | |
| B. | 氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2+Cl2═2HCl | |
| C. | 铜与稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
19.对反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2△H3=-260.2 kJ•mol-1处于化学平衡状态时的描述,不正确的是( )
| A. | CO的含量保持不变 | |
| B. | 容器中CH3OCH3浓度与CO2浓度可能相同 | |
| C. | 3V正(CO)=V正(CH3OCH3) | |
| D. | 体系的温度保持不变 |
16.下列因果关系成立的是( )
| A. | 因为SiO2能与强碱溶液反应,所以盛装强碱溶液的试剂瓶不用玻璃塞 | |
| B. | 因为SO2可以使溴水褪色,所以SO2具有漂白性 | |
| C. | 因为某碱性溶液的焰色呈黄色,所以其溶质为NaOH | |
| D. | 因为NH3的水溶液可以导电,所以NH3是电解质 |
14.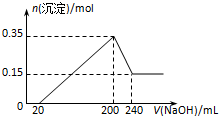 将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示..则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示..则下列说法不正确的是( )
 将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示..则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示..则下列说法不正确的是( )| A. | 镁和铝的总质量为9 g | |
| B. | 最初20 mLNaOH溶液用于中和过量的硫酸 | |
| C. | 硫酸的物质的量浓度为5 mol•L-1 | |
| D. | 生成的氢气在标准状况下的体积为11.2 L |
 A、B、C、D 是原子序数依次增大的短周期主族元素,A 的基态原子中电 子占据三个能级,且各个能级的电子数相等;B 的一种氧化物为红棕色气体;C 的原子半径 是短周期中最大的.D 的电负性是同周期中最大的;E 是第四周期第VIII族三种元素中原子序数 最小的元素.用元素符号回答下列问题:
A、B、C、D 是原子序数依次增大的短周期主族元素,A 的基态原子中电 子占据三个能级,且各个能级的电子数相等;B 的一种氧化物为红棕色气体;C 的原子半径 是短周期中最大的.D 的电负性是同周期中最大的;E 是第四周期第VIII族三种元素中原子序数 最小的元素.用元素符号回答下列问题: