题目内容
1.有机物H的分子式为C6H10O4,1molH与足量的碳酸氢钠反应生成44.8LCO2(标准情况),H分子只含1个甲基.则H的结构有(不含立体结构)| A. | 4种 | B. | 6种 | C. | 8种 | D. | 9种 |
分析 1molH与足量的碳酸氢钠反应生成CO2为2mol,说明H分子中含有2个-COOH,可以看作丁烷中2个H原子被-COOH取代,丁烷有正丁烷、异丁烷,H分子只含1个甲基,正丁烷被取代,其中1个羧基一定取代端位甲基上-COOH,移动另外的-COOH,若为异丁烷被取代,2个-COOH只能分别取代甲基上H原子.
解答 解:1molH与足量的碳酸氢钠反应生成CO2为$\frac{44.8L}{22.4L/mol}$=2mol,说明H分子中含有2个-COOH,可以看作丁烷中2个H原子被-COOH取代,H分子只含1个甲基,正丁烷(C-C-C-C)被取代,其中1个-COOH处于端位,另外的-COH有3种位置,异丁烷( )被取代,2个-COOH只能分别取代甲基上H原子,有1种,符合条件的同分异构体共有4种,
)被取代,2个-COOH只能分别取代甲基上H原子,有1种,符合条件的同分异构体共有4种,
故选:A.
点评 本题考查限制条件同分异构体书写、官能团的性质,注意利用取代法判断,较好的考查学生分析思维能力.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案
相关题目
12.下列说法不正确的是( )
| A. | 甲苯与氢气完全加成后的产物的一氯代物有5种 | |
| B. | 分子式为C4H9Br的卤代烃 (不考虑立体异构)有4种 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 用甘氨酸(H2N-CH2-COOH)和丙氨酸[CH3CH(NH2)COOH]脱水缩合最多可形成4种二肽 |
16.水溶液中能大量共存的一组离子是( )
| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、H+、CO32-、Cl- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、Fe3+、NO3-、SCN- |
6.科学家研制多种新型杀虫剂代替DDT,化合物A是其中的一种,下列关于化合物A的说法正确的是( )

| A. | 可与FeCl3溶液发生显色反应 | |
| B. | 分子中最少有4个碳原子共平面 | |
| C. | 能发生取代反应和银镜反应 | |
| D. | 与H2完全加成的物质的量之比为1:1 |
3.用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作指示剂,造成测定结果偏高,其原因可能是( )
| A. | 配制标准溶液的NaOH中混有Na2CO3杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其它操作正确 | |
| C. | 滴定前无气泡,滴定终了有气泡 | |
| D. | 配制标准溶液的Na0H中混有Na20杂质 |
20. 以下元素均为短周期元素:
以下元素均为短周期元素:
(1)B在周期表中的位置第二周期第 VIA族,C离子的结构示意图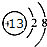 .
.
(2)D的最低价含氧酸的电子式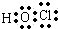 .
.
(3)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式2NH3-6e-+6OH-═N2+6H2O.
(4)A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质.该反应的化学方程式:4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C;
(5)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比为1:1反应的离子方程式为CO32-+Cl2+H2O=ClO-+Cl-+HCO-3.
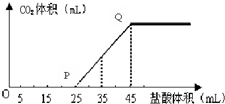
(6)A的最高价氧化物的水化物的溶液中通入一定量CO2得溶液X,X中逐滴加入1mol•L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
①X溶液中溶质的化学式NaOH和Na2CO3.
②当加入35mL盐酸时,产生CO2的体积为224mL(标准状况).
 以下元素均为短周期元素:
以下元素均为短周期元素:| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是 内层电子数的三倍 |
| C | 在第三周期中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
.(2)D的最低价含氧酸的电子式
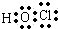 .
.(3)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式2NH3-6e-+6OH-═N2+6H2O.
(4)A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质.该反应的化学方程式:4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C;
(5)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比为1:1反应的离子方程式为CO32-+Cl2+H2O=ClO-+Cl-+HCO-3.
(6)A的最高价氧化物的水化物的溶液中通入一定量CO2得溶液X,X中逐滴加入1mol•L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
①X溶液中溶质的化学式NaOH和Na2CO3.
②当加入35mL盐酸时,产生CO2的体积为224mL(标准状况).
 .
. .
.