题目内容
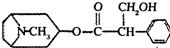
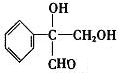
14.下列说法正确的是( )| A. | 按系统命名法的名称为2-甲基-3,5-二乙基乙烷 | |
| B. | 用Na2CO3溶液能区分CH3COOH、CH3CH2OH,苯、硝基苯四种物质 | |
| C. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗氧气的量依次增加 | |
| D. | 下列物质的沸点按由低到高顺序为:CH3(CH2)2CH3<(CH3)3CH<CH3(CH2)3CH3 |
分析 A.主链错误,最长碳链碳原子数为7个;
B.CH3COOH具有酸性,CH3CH2OH易溶于水,苯、硝基苯都不溶于水,但二者的密度大小不同;
C.等质量的烃,含氢量越高耗氧量越高;
D.烷烃的碳原子数越多,沸点越高;碳原子数相同时,支链越多,沸点越低.
解答 解:A.该命名中选取的主链不是最长碳链,该有机物中最长碳链含有7个C,主链为庚烷,编号从右边开始,在2、,5号C各含有1个甲基,在3号C含有1个乙基,该有机物的正确命名为:2,5-二甲基-3-乙基,故A错误;
B.Na2C03溶液能与醋酸反应产生气泡;与CH3CH2OH混合后不反应,但混合液不分层;碳酸钠与苯、硝基苯混合后会分层,有机层在上层的为苯,在下层的为硝基苯,所以能够用Na2C03溶液能区分CH3COOH、CH3CH2OH,苯、硝基苯四种物质,故B正确;
C.烃中含氢量越大,质量不变时消耗的氧气的量越大;甲烷、乙烯、1,3一丁二烯中含氢量大小关系为:甲烷>乙烯>1,3-丁二烯,所以耗氧量依次减小,故C错误;
D.烷烃的C原子数目越多,沸点越高,如果C的数目相同,支链越多,沸点越低,所以沸点大小为:CH3)3CH<CH3(CH2)2CH3<(CH3)2CHCH2CH2<CH3(CH2)3CH3,故D错误;
故选B.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的组成、结构和性质,难度不大,注意相关基础知识的积累.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
4.25℃时,在NH4+的浓度均为1mol•L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得三种物质的浓度分别为a、b、c(mol•L-1),则下列判断正确的是( )
| A. | a>b>c | B. | c>a>b | C. | b>a>c | D. | a>c>b |
5.当光束通过下列分散系时,能产生丁达尔效应的是( )
| A. | CuSO4溶液 | B. | Na2CO3溶液 | C. | Fe(OH)3胶体 | D. | Ba(OH)2溶液 |
2.下列事实不能用平衡移动原理解释的是( )
| A. | Mg(OH)2不溶于水,但能溶于浓NH4Cl溶液中 | |
| B. | 水垢中含有的CaSO4,先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,再用酸除去 | |
| C. | 洗涤BaSO4沉淀时,用稀硫酸洗涤BaSO4沉淀比用蒸馏水洗涤损失少 | |
| D. | FeCl3溶液中混有FeCl2,常加入少量的H2O2,使Fe2+氧化为Fe3+ |
9.钠在一定条件下可以在CO2中燃烧生成Na2O和C,下列说法不正确的是( )
| A. | 该条件下,钠的还原性强于C | |
| B. | 若CO2过量,则有Na2CO3生成 | |
| C. | 该反应中化学能除转化为热能外,还转化为电能 | |
| D. | Na2O是离子化合物,其中离子半径:r(Na+)>r(O2-) |
19.某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质.
Ⅰ、他们先把铜粉放在空气中灼烧,再与稀硝酸反应制取硝酸铜.
(1)如果直接用铜屑与稀硝酸反应来制取硝酸铜:
1铜屑与稀硝酸反应的化学反应方程式为3Cu+8HNO3═3Cu(NO3)3+NO↑+4H2O;
②可能导致的两个不利因素是成等物质的量的硝酸铜,消耗硝酸原料多、且产生污染物氮氧化物.
(2)实验中,欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤按顺序是蒸发浓缩、冷却结晶、过滤、晾干.
Ⅱ、为了探究Cu(NO3)2在酸性条件下跟铁单质的反应.他们取一支试管,加入Cu(NO3)2溶液,滴入适量稀硫酸酸化,再加入一定量铁粉,实验后没有固体残留物质.
(3)该探究小组对反应后溶液中铁元素的价态进行探究,他们设计了实验方案,并进行实验.请按下表格式补充写出实验操作步骤、预期现象与结论.
Ⅰ、他们先把铜粉放在空气中灼烧,再与稀硝酸反应制取硝酸铜.
(1)如果直接用铜屑与稀硝酸反应来制取硝酸铜:
1铜屑与稀硝酸反应的化学反应方程式为3Cu+8HNO3═3Cu(NO3)3+NO↑+4H2O;
②可能导致的两个不利因素是成等物质的量的硝酸铜,消耗硝酸原料多、且产生污染物氮氧化物.
(2)实验中,欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤按顺序是蒸发浓缩、冷却结晶、过滤、晾干.
Ⅱ、为了探究Cu(NO3)2在酸性条件下跟铁单质的反应.他们取一支试管,加入Cu(NO3)2溶液,滴入适量稀硫酸酸化,再加入一定量铁粉,实验后没有固体残留物质.
(3)该探究小组对反应后溶液中铁元素的价态进行探究,他们设计了实验方案,并进行实验.请按下表格式补充写出实验操作步骤、预期现象与结论.
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:观察样品 | 溶液呈蓝绿色,①不能(填“能”或“不能”)确定产物中铁元素的价态 |
| 步骤2:取少量溶液,滴加酸性KMnO4溶液 | ②若KMnO4溶液的紫红色褪去或变浅,则说明产物中含+2价铁元素,若KMnO4溶液不褪色或不变浅,则说明产物中不含+2价铁元素 |
| 步骤3:③另取少量溶液,滴加KSCN溶 | ③若溶液变为红色,说明产物中含+3价铁元素;若溶液颜色无明显变化,则说明产物中不含+3价的铁元素 |
6.下列化学反应的离子方程式正确的是( )
| A. | 向Na2SiO3溶液中通入过量CO2:SiO32-+2CO2+2H2O═2HCO3-+H2SiO3↓ | |
| B. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 向NH4HCO3溶液中加入足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O |
12. 化学兴趣小组的同学用0.100 0 mol/L 盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
化学兴趣小组的同学用0.100 0 mol/L 盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
(1)配制待测液:用分析天平准确称取烧碱样品2.500 g,全部溶于水配制成500 mL溶液.配制溶液需用的玻璃仪器除了烧杯、胶头滴管外,还需要500mL容量瓶、量筒.
(2)滴定:
①用碱式滴定管量取20.00mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测.滴定管在装入反应液之前应进行的操作有检查滴定管是否漏水,洗净并用待盛装的溶液润洗滴定管2~3次.
②用浓度为0.100 0mol/L的盐酸标准溶液进行滴定.开始滴定前的一步操作是调节液面于“0”刻度或“0”刻度以下.
③滴定过程中用pH计测定锥形瓶中溶液的pH,临近滴定终点时每滴一滴测一次pH.滴定过程中,测得锥形瓶中溶液的pH变化如下表:
(3)数据处理:
①在坐标图中绘出上述中和滴定曲线.
②所测样品中NaOH的质量百分含量为96%.
 化学兴趣小组的同学用0.100 0 mol/L 盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
化学兴趣小组的同学用0.100 0 mol/L 盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:(1)配制待测液:用分析天平准确称取烧碱样品2.500 g,全部溶于水配制成500 mL溶液.配制溶液需用的玻璃仪器除了烧杯、胶头滴管外,还需要500mL容量瓶、量筒.
(2)滴定:
①用碱式滴定管量取20.00mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测.滴定管在装入反应液之前应进行的操作有检查滴定管是否漏水,洗净并用待盛装的溶液润洗滴定管2~3次.
②用浓度为0.100 0mol/L的盐酸标准溶液进行滴定.开始滴定前的一步操作是调节液面于“0”刻度或“0”刻度以下.
③滴定过程中用pH计测定锥形瓶中溶液的pH,临近滴定终点时每滴一滴测一次pH.滴定过程中,测得锥形瓶中溶液的pH变化如下表:
| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 |
| V(HCl)/mL | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 | |
| pH | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
①在坐标图中绘出上述中和滴定曲线.
②所测样品中NaOH的质量百分含量为96%.
 或
或 ;
;