题目内容
11.由中国科研人员从中药材中提取的金丝桃素对感染H7N9禽流感的家禽活体具有一定的治愈率.金丝桃素的结构简式如下: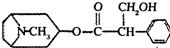
请回答下列问题:
(1)金丝桃素能在NaOH溶液中加热反应得A和B,已知B为芳香族化合物,则A的分子式是C8H15NO;
(2)室温下,B 用稀盐酸酸化得C,C中含氧官能团的名称是羟基、羧基;
(3)两分子C与浓H2SO4共热,可生成含有八元环的化合物,该反应的反应类型是酯化反应或取代反应;
(4)写出一种符合下列条件的C的同分异构体的结构简式
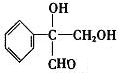 或
或 ;
;①苯环上只有一个支链 ②含有醛基 ③1mol该有机物与足量金属钠反应产生1mol气体.
分析 (1)金丝桃素中含酯基,在NaOH溶液中加热条件下发生水解反应得到A和B,已知B为芳香族化合物,则B中含苯环,所以生成A为 ;
;
(2)B用稀盐酸酸化得C,则C为 ;
;
(3)两分子C与浓H2SO4共热,可生成含有八元环的化合物,发生-OH与-COOH的酯化反应;
(4)C的同分异构体符合:①苯环上只有一个支链,②含有醛基,③1mol该有机物与足量金属钠反应产生1mol气体,则C的同分异构体侧链中含1个-CHO和2个-OH.
解答 解:(1)金丝桃素中含酯基,在NaOH溶液中加热条件下发生水解反应得到A和B,已知B为芳香族化合物,则B中含苯环,所以生成A为 ,其分子式为C8H15NO,
,其分子式为C8H15NO,
故答案为:C8H15NO;
(2)B用稀盐酸酸化得C,则C为 ,含-OH、-COOH,名称分别为羟基、羧基,
,含-OH、-COOH,名称分别为羟基、羧基,
故答案为:羟基、羧基;
(3)两分子C与浓H2SO4共热,可生成含有八元环的化合物,发生-OH与-COOH的酯化反应,也属于取代反应,
故答案为:酯化反应或取代反应;
(4)C的同分异构体符合:①苯环上只有一个支链,②含有醛基,③1mol该有机物与足量金属钠反应产生1mol气体,则C的同分异构体侧链中含1个-CHO和2个-OH,则符合条件的同分异构体的结构简式为 或
或 ,
,
故答案为: 或
或 .
.
点评 本题考查有机物的结构与性质,侧重酯的性质及同分异构体的考查,把握官能团与性质的关系为解答的关键,注重学生知识迁移应用能力及信息获取能力的综合应用,题目难度中等.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
14.下列说法正确的是( )
| A. | 按系统命名法的名称为2-甲基-3,5-二乙基乙烷 | |
| B. | 用Na2CO3溶液能区分CH3COOH、CH3CH2OH,苯、硝基苯四种物质 | |
| C. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗氧气的量依次增加 | |
| D. | 下列物质的沸点按由低到高顺序为:CH3(CH2)2CH3<(CH3)3CH<CH3(CH2)3CH3 |
11.下列离子能大量共存的一组是( )
| A. | K+、Ca2+、Cl-、CO32- | B. | Fe2+、Al3+、NO3-、SO42- | ||
| C. | Mg2+、NH4+、CO32-、H+ | D. | Na+、Br-、ClO-、H+ |
6.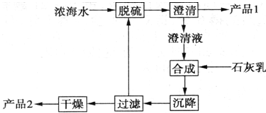 将海水淡化与浓缩海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓缩海水中通过一系列工艺流程提取其他产品.
将海水淡化与浓缩海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓缩海水中通过一系列工艺流程提取其他产品.
回答下列问题:
(1)采用空气吹出法从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收1molBr2时,转移的电子为$\frac{5}{3}$mol.
(2)海水提镁的一段工艺流程如下图:
浓主要成分如下:
产品2的化学式为Mg(OH)2,1L浓海水最多可得到产品2的质量为69.6g.
(3)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$ Mg+Cl2↑,电解时,若有少量水存在会造成产品镁的消耗,写出有关的化学方程式Mg+2H2O$\frac{\underline{\;高温\;}}{\;}$ Mg(OH)2+H2↑.
 将海水淡化与浓缩海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓缩海水中通过一系列工艺流程提取其他产品.
将海水淡化与浓缩海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓缩海水中通过一系列工艺流程提取其他产品.回答下列问题:
(1)采用空气吹出法从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收1molBr2时,转移的电子为$\frac{5}{3}$mol.
(2)海水提镁的一段工艺流程如下图:
浓主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
(3)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$ Mg+Cl2↑,电解时,若有少量水存在会造成产品镁的消耗,写出有关的化学方程式Mg+2H2O$\frac{\underline{\;高温\;}}{\;}$ Mg(OH)2+H2↑.
16.常见金属单质A可发生如图1所示转化(部分反应物、产物和反应条件已略去).F是一种温室气体;气体G的水溶液显弱碱性;H是一种红褐色的氧化物;B、C、D、E四种化合物中含有一种相同的元素.请回答下列问题:
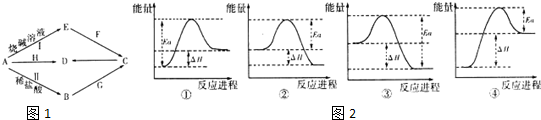
(1)写出G的电子式 ,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O.
,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O.
(2)写出反应I的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)反应I、Ⅱ均有清洁能源H2产生.已知H2的燃烧热为286kJ•mol-1,18g水蒸气变成液态水放出44kJ的热量.其它相关数据如下表:
则表中x为436.
(4)写出A与H反应的化学方程式Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,实验测得该反应的焓变(△H)和活化能(Ea).下列能量关系图2合理的是②③(填写序号).
(5)资料显示和H组成相似的另外一种具有磁性的物质可用于除去地下水中的TcO4-(99Tc具有放射性).在酸性条件下,H将TcO4-转化为难溶于水的TcO2,同时得到一种难溶于水的弱碱,该反应的离子方程式为3Fe3O4+TcO4-+13H2O+H+=TcO2+9Fe(OH)3.

(1)写出G的电子式
 ,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O.
,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O.(2)写出反应I的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)反应I、Ⅱ均有清洁能源H2产生.已知H2的燃烧热为286kJ•mol-1,18g水蒸气变成液态水放出44kJ的热量.其它相关数据如下表:
| 化学键 | O=O(g) | H-H(g) | H-O(g) |
| 键能/kJ•mol-1 | 496 | x | 463 |
(4)写出A与H反应的化学方程式Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,实验测得该反应的焓变(△H)和活化能(Ea).下列能量关系图2合理的是②③(填写序号).
(5)资料显示和H组成相似的另外一种具有磁性的物质可用于除去地下水中的TcO4-(99Tc具有放射性).在酸性条件下,H将TcO4-转化为难溶于水的TcO2,同时得到一种难溶于水的弱碱,该反应的离子方程式为3Fe3O4+TcO4-+13H2O+H+=TcO2+9Fe(OH)3.
3.(I)在一个容积固定不变的密闭容器中进行反应:2X(g)+Y(g)?2Z(g),已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol.回答下列问题:
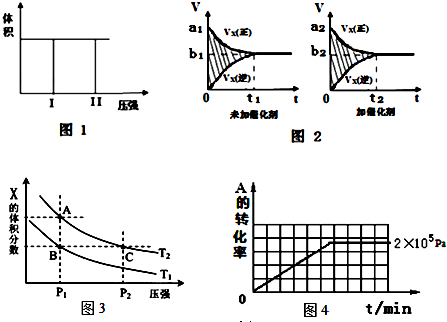
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H< 0; 熵变△S<0 ( 填:“<,>,=”).该反应在低温(填高温或低温)条件下能自发进行.
该反应的v-t图象如图2中甲图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中乙图所示.以下说法正确的是②③⑤
①a1>a2 ②b1<b2 ③t1>t2 ④右图中阴影部分面积更大⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示.下列说法正确的是BD.
A.A、C两点的反应速率:A>C B.A、C两点的气体密度:A<C
C.B、C两点的气体的平均相对分子质量:B<C D.由状态B到A,可以用加热的方法
(II)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
(1)当压强从2×105Pa增加到5×105 Pa时,平衡不移动(填:向左,向右,不)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是a+bmol.
(2)其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图4,请在图4中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图4上画出曲线并标出相应压强).

(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H< 0; 熵变△S<0 ( 填:“<,>,=”).该反应在低温(填高温或低温)条件下能自发进行.
该反应的v-t图象如图2中甲图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中乙图所示.以下说法正确的是②③⑤
①a1>a2 ②b1<b2 ③t1>t2 ④右图中阴影部分面积更大⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示.下列说法正确的是BD.
A.A、C两点的反应速率:A>C B.A、C两点的气体密度:A<C
C.B、C两点的气体的平均相对分子质量:B<C D.由状态B到A,可以用加热的方法
(II)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
(2)其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图4,请在图4中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图4上画出曲线并标出相应压强).
20.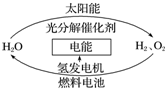 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法正确的是( )
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法正确的是( )
 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法正确的是( )
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法正确的是( )| A. | 氢能源已被普遍使用 | |
| B. | H2O的分解反应是吸热反应 | |
| C. | 氢气不易贮存和运输,无开发利用价值 | |
| D. | 2 mol 液态H2O具有的总能量高于2 mol H2和1 mol O2的能量 |
1.分类法是一种行之有效、简单易行的科学方法.下列关于“Na2CO3”的分类错误的是( )
| A. | 电解质 | B. | 碳酸盐 | C. | 钠盐 | D. | 碱 |