题目内容
14.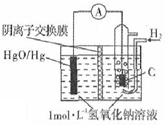 某原电池的装置如图所示,总反应为H2(g)+HgO(s)=H20(1)+Hg(1),其中阴离子交换膜只允许阴离子和水分子通过.下列说法正确的是( )
某原电池的装置如图所示,总反应为H2(g)+HgO(s)=H20(1)+Hg(1),其中阴离子交换膜只允许阴离子和水分子通过.下列说法正确的是( )| A. | 正极反应为:HgO(s)-2e-+H20=Hg(l)+2OH- | |
| B. | 放电结束后,溶液中的pH值下降 | |
| C. | 每反应2.24L氢气,交换膜通过0.2mol离子 | |
| D. | 电子通过离子交换膜从负极向正极移动,保持溶液中电荷平衡 |
分析 根据总反应为H2(g)+HgO(s)=H2O(1)+Hg(1),可知氢气在负极失电子发生氧化反应,氧化汞在正极得电子发生还原反应,放电过程中生成水,电解质氢氧化钠溶液的浓度降低,根据负极电极反应式H2-2e-+2OH-=2H2O,每反应1mol氢气,转移电子0.2mol,交换膜通过0.2mol离子,电子从负极流出经导线流向正极,不能通过溶液,据此分析解答.
解答 解:根据总反应为H2(g)+HgO(s)=H2O(1)+Hg(1),可知氢气在负极失电子发生氧化反应,氧化汞在正极得电子发生还原反应,放电过程中生成水,电解质氢氧化钠溶液的浓度降低,根据负极电极反应式H2-2e-+2OH-=2H2O,每反应1mol氢气,转移电子0.2mol,交换膜通过0.2mol离子,电子从负极流出经导线流向正极,不能通过溶液,
A.氧化汞在正极得电子发生还原反应,故A错误;
B.放电过程中生成水,电解质氢氧化钠溶液的浓度降低,PH下降,故B正确;
C.题中没有给出标况,不能计算,故C错误;
D.电子从负极流出经导线流向正极,不能通过溶液,故D错误;
故选B.
点评 本题考查了原电池原理的应用,注意把握原电池原理及正负极的判断和电极方程式的书写,利用电子及电荷守恒来解决原电池中有关问题,题目难度中等.

练习册系列答案
相关题目
4.COCl2(g)?CO(g)+Cl2(g)△H>0,当反应达到平衡时,下列措施能提高COCl2转化率的是( )
| A. | 恒容通入惰性气体 | B. | 恒压时通入惰性气体 | ||
| C. | 恒容通入COCl2气体 | D. | 加催化剂 |
5.根据元素周期表和元素周期律,下列推断中错误的是( )
| A. | 砹是一种有色固体,它的气态氢化物很不稳定砹化银为有色沉淀且不溶解于稀硝酸 | |
| B. | 在周期表中金属和非金属元素的分界线附近可以寻找制取新农药的元素 | |
| C. | 镭(第ⅡA族)的硫酸盐难溶解于水,其氢氧化物是强碱 | |
| D. | 溴化氢没有氯化氢稳定,其水溶液的还原性是盐酸弱于氢溴酸 |
9.某物质的结构为: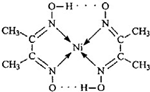 .对该物质的分析判断正确的是( )
.对该物质的分析判断正确的是( )
 .对该物质的分析判断正确的是( )
.对该物质的分析判断正确的是( )| A. | 该物质是中不存在σ键 | |
| B. | 该物质的分子中只含有共价键、配位键两种作用力 | |
| C. | 该物质是一种配合物,其中N 原子为配位体 | |
| D. | 该物质中C、N、O 原子存在孤对电子 |
19.宣传科学,介绍高新技术,揭露伪科学,是教育者的义务,下列各项中属于伪科学的是( )
| A. | 用催化剂将水变成油 | B. | 稻草可变成酒精 | ||
| C. | 在异地“发功”给人治病 | D. | 用碘化银人工降雨 |
6.常见有机反应类型有:①取代反应、②加成反应、③消去反应、④酯化反应、⑤加聚反应、⑥氧化反应、⑦还原反应,其中能在有机物中引入羟基的反应类型是( )
| A. | ①②③ | B. | ①②⑥⑦ | C. | ⑤⑥⑦ | D. | ③④⑥ |
3.下列说法正确的是( )
| A. | 煤的干馏、石油分馏、石油裂解都是化学反应 | |
| B. | 煤经过气化、液化等化学变化可得到清洁燃料 | |
| C. | 人造纤维、合成纤维和油脂都是有机高分子化合物 | |
| D. | 棉花、羊毛、蚕丝、麻都由C、H、O元素构成 |
4.X、Y、Z是三种不同的金属,将X、Y分别放入稀盐酸中,只有X表面产生气泡;将Y、Z分别放入硝酸银溶液中,一会儿后,Y表面有银析出,而Z无变化.根据以上实验事实,判断三种金属的活动性顺序为( )
| A. | X>Y>Z | B. | X>Z>Y | C. | Z>X>Y | D. | Y>Z>X |