题目内容
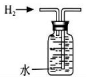
15.写出以石墨作电极电解盐酸的电极反应式:阳极:2Cl--2e-═Cl2↑
阴极:2H++2e-═H2↑
总反应:2HCl$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑.
分析 以石墨为电极电解HCl溶液时,阴极上H2O得电子生成H2,阳极上Cl-失电子生成Cl2,以此解答该题.
解答 解:电解盐酸,阳极发生氧化反应,氯离子被氧化生成氯气,电极方程式为2Cl--2e-═Cl2↑,阴极发生还原反应,氢离子得到电子被还有生成氢气,电极方程式为2H++2e-═H2↑,总方程式为2HCl$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑,
故答案为:2Cl--2e-═Cl2↑;2H++2e-═H2↑;2HCl$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑.
点评 本题以电极反应式书写为载体考查电解原理,为高频考点,明确各个电极上发生的反应是解本题关键,熟练掌握阴阳离子放电顺序,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
6.随着人们生活质量的不断提高,废电池必须集中处理的问题越来越受到重视.其主要原因是( )
| A. | 回收废电池外壳的金属材料 | |
| B. | 防止废电池中的汞、镉和铅等重金属离子对土壤和水源的污染 | |
| C. | 不使电池中渗漏的电解液腐蚀其他物品 | |
| D. | 提炼稀有金属 |
10.有4种碳架如图所示的烃,下列说法正确的是( )

| A. | a和c是同分异构体 | B. | b和c是同系物 | ||
| C. | a和d都能使酸性高锰酸钾褪色 | D. | 只有b和c能发生取代反应 |
20.一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g),达到平衡后测得A气体的浓度为1mol•L-1,当恒温下将密闭容器的容积扩大到2倍再达到平衡后,测得A的浓度为0.7mol•L-1,则下列叙述正确的是( )
| A. | 平衡向正反应方向移动 | B. | x+y=z | ||
| C. | C的体积分数升高 | D. | B的转化率降低 |
4.已知重铬酸钾(K2Cr2O7)可将盐酸中的Cl-氧化为氯气,同时自身被还原为Cr3+0.1mol K2Cr2O7可氧化Cl-的物质的量为( )
| A. | 0.2 mol | B. | 0.3 mol | C. | 0.6 mol | D. | 1.4 mol |
5.下列根据实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将SO2气体通入Ba(NO3)2溶液 | 有白色沉淀 | SO2中一定含有SO3 |
| B | 向NAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
| C | AgCl悬浊液中滴入少量Na2S溶液 | 沉淀变黑色 | Ksp(Ag2S)>Ksp(AgCl) |
| D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中无存在平衡:I3-?I2+I- |
| A. | A | B. | B | C. | C | D. | D |