题目内容
16.25℃时,常见的无机酸在水溶液中的电离子平衡常数如表,下列选项正确的是( )| 氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
| K=4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 | K=6.61×10-4 |
| A. | 氰化钠溶液中通入少量CO2:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN-)>c(HCN)>c(H+)>c(OH+) | |
| C. | 0.2 mol•L-1 HCN溶液与0.1mol•L-1NaOH溶液等体积混合后,溶液中各种离子的浓度关系有:2[c(H+)-c(OH+)]=c(CN+)-c(HCN) | |
| D. | 等体积、等浓度的NaCN和NaF溶液中所含离子总数前者大于后者 |
分析 A.酸的电离平衡常数越大,其电离程度越大,则酸根离子水解程度越小,根据电离平衡常数知,HCN的酸性大于H2CO3,结合强酸制取弱酸判断;
B.依据溶液中电荷守恒分析;
C.0.2 mol•L-1 HCN溶液与0.1mol•L-1NaOH溶液等体积混合后得到等浓度的NaCN和HCN混合溶液,溶液中存在物料守恒和电荷守恒,据此计算分析;
D.根据电荷守恒,c(F-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+ )+n(H+)的2倍,NaCN水解程度大于NaF比较离子浓度大小.
解答 解:A.根据电离平衡常数知,HCN的酸性大于H2CO3,结合强酸制取弱酸知,CN-和二氧化碳不反应,故A错误;
B.NaCN与HCN的混合溶液中一定有c(Na+)+c(H+)=c(CN-)+c(OH+),若c(Na+)>c(CN-),则c(H+)<c(OH+),故B错误;
C.0.2 mol•L-1 HCN溶液与0.1mol•L-1NaOH溶液等体积混合后得到等浓度的NaCN和HCN混合溶液,溶液中存在电荷守恒为:c(Na+)+c(H+)=c(CN-)+c(OH+),物料守恒c(CN-)+c(HCN)=2c(Na+),代入得到溶液中各种离子的浓度关系有:2[c(H+)-c(OH+)]=c(CN+)-c(HCN),故C正确;
D.根据电荷守恒,c(F-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+ )+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以氟化钠中离子浓度大,等体积、等浓度的NaCN和NaF溶液中所含离子总数前者小于后者,故D错误;
故选C.
点评 本题考查了弱电解质的电离,明确酸的电离平衡常数与酸电离程度、酸根离子水解程度的关系是解本题关键,再结合物料守恒、电荷守恒解答即可,题目难度中等.

| A. | 金刚石和晶体硅 | B. | CO2和SiO2 | C. | KCl和HBr | D. | NaOH和NaCl |
| A. | 乙烯分子的双键中有一个键较易断裂 | |
| B. | 乙烯分子里所有原子都在同一平面上,且碳氢键之间的键角为120° | |
| C. | 乙烯分子中2个碳原子都是sp2杂化,乙烯分子有5个σ键 | |
| D. | 乙烯和环丙烷(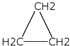 )的分子组成符合通式CnH2n,因此它们属于同系物 )的分子组成符合通式CnH2n,因此它们属于同系物 |
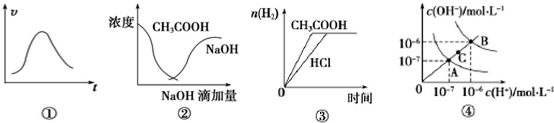
| A. | 图①可表示一定条件下,锌和稀硫酸反应的速率随时间变化的趋势图 | |
| B. | 图②中曲线表示将氢氧化钠溶液滴加到醋酸溶液中浓度的变化趋势图 | |
| C. | 图③表示等体积、等物质的量浓度的盐酸和醋酸,分别加足量镁粉,产生H2的物质的量变化 | |
| D. | 图④为水的电离平衡曲线图,若从A点到C点,可采用升高温度的方法 |
| 选项 | 实验 | 解释或结论 |
| A | 向包有Na2O2的脱脂棉滴少量水,脱脂棉燃烧 | Na2O2与H2O反应放热并有O2生成 |
| B | 向NaI溶液滴加FeCl3溶液,再加入CCl4,振荡,静置,下层呈紫红色 | 氧化性:I2>Fe3+ |
| C | 取酸雨试样,滴加H2O2溶液,再加入BaCl2溶液,有白色沉淀 | 该酸雨试样中一定含有H2SO3 |
| D | 用激光笔照射水玻璃(Na2SiO3的溶液),有丁达尔现象 | SiO32-水解生成了硅酸胶体 |
| A. | A | B. | B | C. | C | D. | D |
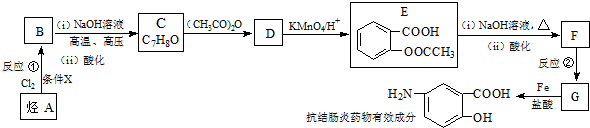
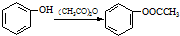
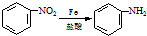
 ;反应①的反应条件是FeCl3作催化剂;反应②的反应类型是取代反应;
;反应①的反应条件是FeCl3作催化剂;反应②的反应类型是取代反应; ;
;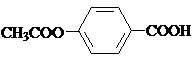 ,
, ;
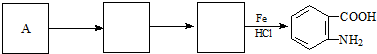
;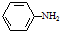 )易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸(
)易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸(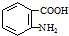 )合成路线中两种中间产物的结构简式(部分反应条件已略去)
)合成路线中两种中间产物的结构简式(部分反应条件已略去)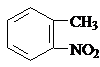 ,
,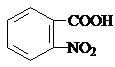 .
.
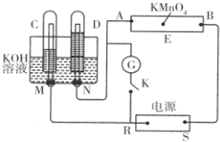 现有一套电化学装置,如图所示,E 为沾有 Na2SO4溶液的滤纸,并加入几滴酚酞.A、B分别为Pt片,压在滤纸两端,R、S为电源的电极.M、N是用多微孔的 Ni 制成的电极材料,它在碱性溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的 KMnO4溶液,断开K,接通外电源一段时间后,C、D中有气体产生.
现有一套电化学装置,如图所示,E 为沾有 Na2SO4溶液的滤纸,并加入几滴酚酞.A、B分别为Pt片,压在滤纸两端,R、S为电源的电极.M、N是用多微孔的 Ni 制成的电极材料,它在碱性溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的 KMnO4溶液,断开K,接通外电源一段时间后,C、D中有气体产生.