题目内容
18.用双线桥法分析下列氧化还原反应电子转移情况与数目,指出氧化剂和还原剂,氧化产物和还原产物:①2F2+2H2O═4HF+O2
②2Na+2H2O═2NaOH+H2↑
③Zn+H2SO4═ZnSO4+H2↑
④2KClO3═2KCl+3O2↑
⑤CuO+H2═Cu+H2O
⑥2H2O2═2H2O+O2↑
⑦3Cl2+8NH3═6NH4Cl+N2
⑧2KMnO4═K2MnO4+MnO2+O2↑
⑨3FeCl2+4HNO3═2FeCl3+NO↑+2H2O+Fe(NO3)3.
分析 氧化还原反应中,化合价升高元素所在的反应物做还原剂,对应的产物是氧化产物,化合价降低元素所在的反应物是氧化剂,对应产物是还原产物.
①2F2+2H2O═4HF+O2中F的化合价降低,O的化合价升高,转移电子是4mol;
②2Na+2H2O═2NaOH+H2↑中H的化合价降低,Na的化合价升高,转移电子是2mol;
③Zn+H2SO4═ZnSO4+H2↑中H的化合价降低,Zn的化合价升高,转移电子是2mol;
④2KClO3═2KCl+3O2↑中Cl的化合价降低,O的化合价升高,转移电子是12mol;
⑤CuO+H2═Cu+H2O中Cu的化合价降低,H的化合价升高,转移电子是2mol;
⑥2H2O2═2H2O+O2↑中O的化合价降低,O的化合价升高,转移电子是2mol;
⑦3Cl2+8NH3═6NH4Cl+N2中Cl的化合价降低,N的化合价升高,转移电子是6mol;
⑧2KMnO4═K2MnO4+MnO2+O2↑中Mn的化合价降低,O的化合价升高,转移电子是4mol;
⑨3FeCl2+4HNO3═2FeCl3+NO↑+2H2O+Fe(NO3)3中N的化合价降低,Fe的化合价升高,转移电子是3mol.
解答 解:①2F2+2H2O═4HF+O2中F的化合价降低,O的化合价升高,所以F2是氧化剂,H2O是还原剂,HF是还原产物,O2是氧化产物,转移电子是4mol,电子转移情况如下: ;故答案为:
;故答案为: ;F2是氧化剂,H2O是还原剂;HF是还原产物,O2是氧化产物;
;F2是氧化剂,H2O是还原剂;HF是还原产物,O2是氧化产物;
②2Na+2H2O═2NaOH+H2↑中H的化合价降低,Na的化合价升高,所以H2O是氧化剂,Na是还原剂,转移电子是2mol,电子转移情况如下: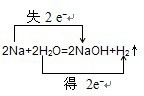 ;故答案为:
;故答案为: ;H2O是氧化剂,Na是还原剂,NaOH是氧化产物,H2是还原产物;
;H2O是氧化剂,Na是还原剂,NaOH是氧化产物,H2是还原产物;
③Zn+H2SO4═ZnSO4+H2↑中H的化合价降低,Zn的化合价升高,所以H2SO4是氧化剂,Zn是还原剂,ZnSO4是氧化产物,H2是还原产物,转移电子是2mol,电子转移情况如下: ;H2SO4是氧化剂,Zn是还原剂,ZnSO4是氧化产物,H2是还原产物;
;H2SO4是氧化剂,Zn是还原剂,ZnSO4是氧化产物,H2是还原产物;
④2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑中Cl的化合价降低,O的化合价升高,所以KClO3是氧化剂,KClO3是还原剂,KCl是还原产物,O2是氧化产物,转移电子是12mol,电子转移情况如下: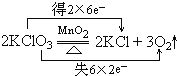 ;故答案为:
;故答案为: ;KClO3是氧化剂,KClO3是还原剂,KCl是还原产物,O2是氧化产物;
;KClO3是氧化剂,KClO3是还原剂,KCl是还原产物,O2是氧化产物;
⑤CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O中Cu的化合价降低,H的化合价升高,所以CuO是氧化剂,H2是还原剂,Cu是还原产物,H2是氧化产物,转移电子是2mol,电子转移情况如下: ;故答案为:
;故答案为: ;CuO是氧化剂,H2是还原剂,Cu是还原产物,H2是氧化产物;
;CuO是氧化剂,H2是还原剂,Cu是还原产物,H2是氧化产物;
⑥2H2O2═2H2O+O2↑中O的化合价降低,O的化合价升高,所以H2O2是氧化剂,H2O2是还原剂,H2O是还原产物,O2是氧化产物,转移电子是2mol,电子转移情况如下: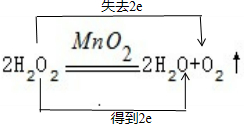 ;故答案为:
;故答案为: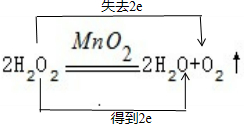 ;H2O2是氧化剂,H2O2是还原剂,H2O是还原产物,O2是氧化产物;
;H2O2是氧化剂,H2O2是还原剂,H2O是还原产物,O2是氧化产物;
⑦3Cl2+8NH3═6NH4Cl+N2中Cl的化合价降低,N的化合价升高,所以Cl2是氧化剂,NH3是还原剂,NH4Cl是还原产物,N2是氧化产物,转移电子是6mol,电子转移情况如下: ;故答案为:
;故答案为: ;Cl2是氧化剂,NH3是还原剂,NH4Cl是还原产物,N2是氧化产物;
;Cl2是氧化剂,NH3是还原剂,NH4Cl是还原产物,N2是氧化产物;
⑧2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑中Mn的化合价降低,O的化合价升高,所以KMnO4是氧化剂,KMnO4是还原剂,K2MnO4、MnO2是还原产物,O2是氧化产物,转移电子是4mol,电子转移情况如下: ;KMnO4是氧化剂,KMnO4是还原剂,K2MnO4、MnO2是还原产物,O2是氧化产物;
;KMnO4是氧化剂,KMnO4是还原剂,K2MnO4、MnO2是还原产物,O2是氧化产物;
⑨3FeCl2+4HNO3═2FeCl3+NO↑+2H2O+Fe(NO3)3中N的化合价降低,Fe的化合价升高,所以HNO3是氧化剂,FeCl2是还原剂,NO是还原产物,FeCl3、Fe(NO3)3是氧化产物,转移电子是3mol,电子转移情况如下: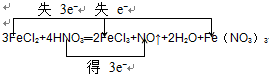 ;
;
故答案为: ;HNO3是氧化剂,FeCl2是还原剂,NO是还原产物,FeCl3、Fe(NO3)3是氧化产物.
;HNO3是氧化剂,FeCl2是还原剂,NO是还原产物,FeCl3、Fe(NO3)3是氧化产物.
点评 本题考查氧化还原反应,为高频考点,侧重于基本概念、电子转移表示方法的考查,难度不大,注意对基础知识的理解掌握.

 名校课堂系列答案
名校课堂系列答案Ⅰ高铁酸盐在能源、环保等方面有着广泛的用途.湿法、干法制备高铁酸盐的原理如下表所示.
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
①反应I的化学方程式为2NaOH+Cl2═NaCl+NaClO+H2O.
②反应II的离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
③已知25℃时Fe(OH)3的Ksp=4.0×10-38,反应II后溶液中c(Fe3+)=4×10-5mol•L-1,则Fe3+完全沉淀时的pH=3.
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,在水中被还原生成Fe(OH)3胶体、有吸附性起净水作用.
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为3﹕1.
(4)高铁电池是正在研制中的可充电干电池,图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长、工作电压稳定.

①是配制一定物质的量浓度的溶液的专用仪器
②使用前要先检查容量瓶是否漏液
③垫上石棉网后容量瓶可以用来加热
④不能用容量瓶贮存配制好的溶液
⑤实验室要用480mL溶液,可以用500mL容量瓶配制.
| A. | ①③ | B. | ①②④ | C. | ①②④⑤ | D. | ①②③④ |
| A. | OCS、CO、CO2、S四种物质的晶体类型相同 | |
| B. | OCS在高温下分解时,碳元素化合价升高 | |
| C. | OCS分子中含有2个σ键和2个π键,它们均属于非极性键 | |
| D. | 22.4 L OCS中约含有3×6.02×1023个原子 |
| A. | SO2 | B. | NO2 | C. | SO3 | D. | CO2 |
| A. | 摩尔是国际单位制中7个基本物理量之一 | |
| B. | 物质的量就是物质的质量 | |
| C. | 物质的量像一座桥梁,把物质的质量或体积等宏观量与微观粒子的数量联系起来 | |
| D. | 是表示物质数量的单位 |
| A. | 1 L水中溶解了58.5g NaCl,该溶液的物质的量浓度为1mol•L-1 | |
| B. | 从1 L 2mol•L-1的H2SO4溶液中取出0.5L,剩余溶液的浓度仍为2mol•L-1 | |
| C. | 制成0.5L 10mol•L-1的盐酸,需标准状况下氯化氢气体112L | |
| D. | 中和100mL 1mol•L-1的H2SO4溶液,需NaOH的质量为4g |
