题目内容
8.化学在物质制备和环保领域有着重要的运用.Ⅰ高铁酸盐在能源、环保等方面有着广泛的用途.湿法、干法制备高铁酸盐的原理如下表所示.
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
①反应I的化学方程式为2NaOH+Cl2═NaCl+NaClO+H2O.
②反应II的离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
③已知25℃时Fe(OH)3的Ksp=4.0×10-38,反应II后溶液中c(Fe3+)=4×10-5mol•L-1,则Fe3+完全沉淀时的pH=3.
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,在水中被还原生成Fe(OH)3胶体、有吸附性起净水作用.
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为3﹕1.
(4)高铁电池是正在研制中的可充电干电池,图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长、工作电压稳定.

分析 本题是利用湿法、干法制备高铁酸盐的原理的探究,涉及反应原理、氧化还原反应分析、利用溶度积的计算等,其中制备高铁酸盐是利用NaClO在碱性条件下的强氧化性将Fe3+氧化成FeO42-,NaClO可通过氯气溶于NaOH溶液得到,制得的高铁酸盐有强氧化性可做水的消毒剂,且其还原产物水解后得到的胶体能吸附悬浮物,可净化水,根据氧化还原的反应可得到制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为;
(1)①反应Ⅰ根据氯气的化学性质,可写出与氢氧化钠溶液反应的化学方程式;
②反应Ⅱ:根据目标产物可知,Fe3+要被溶液里的ClO-在碱性条件下氧化成高铁酸盐,可结合氧化还原反应的理论写出此反应的离子方程式;
③25℃时Fe(OH)3的Ksp=c(Fe3+)×c(OH-)3,将c(Fe3+)=4×10-5mol•L-1代入可计算出c(OH-),可得溶液的pH;
(2)高铁酸钾具有很强的氧化性,能杀菌消毒,在水中生成的Fe(OH)3胶体,有吸附性;
(3)根据化合价的升降来判断,化合价升高的为还原剂,化合价降低的为氧化剂,并根据化学计量数来分析氧化剂和还原剂的比例;
(4)由图可知高铁电池比高能碱性电池放电时间长,工作电压稳定;
解答 解:(1)①反应Ⅰ为氯气溶解于氢氧化钠溶液,发生歧化反应,化学方程式为2NaOH+Cl2═NaCl+NaClO+H2O,故答案为:2NaOH+Cl2═NaCl+NaClO+H2O;
②反应Ⅱ为氧化还原反应,+3价铁被氧化成+6价铁,+1价的氯被氧化为-1价,反应的环境为碱性,化学方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,故答案为:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;
③已知Ksp=c(Fe3+)×c(OH-)3=4.0×10-38,溶液中c(Fe3+)=4×10-5mol•L-1时,c(OH-)=$\root{3}{\frac{4.0×1{0}^{-38}}{4×1{0}^{-5}}}=1{0}^{-11}mol/L$,此时溶液中的c(H+)=$\frac{1×1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L,溶液的pH=3,故答案为:3;
(2)高铁酸钾具有很强的氧化性,能杀菌消毒,在水中被还原得到Fe3+,水解生成Fe(OH)3胶体,有吸附性,故答案为:高铁酸钾有强氧化性,能杀菌消毒,在水中被还原生成Fe(OH)3胶体、有吸附性起净水作用;
(3)干法制备K2FeO4的反应的方程式为:Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O,N元素化合价降低,是氧化剂,铁的化合价降低,是还原剂,氧化剂与还原剂的物质的量之比为3﹕1,故答案为:3﹕1;
(4)由图可知高铁电池比高能碱性电池放电时间长,工作电压稳定,故答案为:放电时间长、工作电压稳定.
点评 实验方案设计与评价是高考不变的一个题型,每年高考必考,是热点题型、也是高考难点之一.本题主要考查了氧化还原反应和离子反应方程式的书写、化学平衡的移动、胶体的净水原理.重点是利用化合价的升价和化学计量数判断氧化剂和还原剂的比例和有关溶度积的计算.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案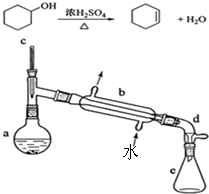 实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如图:
实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如图:相关数据如下:
| 相对分子数量 | 密度 | 沸点 | 溶解性 | |
| 环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环乙烯 | 82 | 0.8102 | 83 | 难溶于水 |
1.【合成】:在a中加入20.00g纯环己醇及2小块沸石,冷却搅动下缓慢加入1mL浓硫酸.b中通入冷却水后,缓慢加热a,控制馏出物的温度不超过90℃.
2.【提纯】:将反应后粗产物倒入分液漏斗中,依次用少量5% Na2CO3溶液和水洗涤,分离后加入无水CaCl2颗粒,静置一段时间后弃去CaCl2.再进行蒸馏最终获得12.30g纯环己烯.
回答下列问题:
(1)装置b的名称是冷凝管.加入沸石的目的是防暴沸.
(2)本实验中最容易产生的副产物的结构简式为
 .
.(3)分液漏斗在使用前必须清洗干净并检漏.本实验分液所得产物应从上口倒出(填“上口”或“下口”).
(4)提纯过程中加入Na2CO3溶液的目的是除去多余的H2SO4,加入无水CaCl2的作用是干燥所得环己烯.
(5)本实验所得环己烯的产率是75%(产率=$\frac{实际产量}{理论产量}$×100%).
(1)用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水.
已知:N2(g)+2O2(g)=N2O4(g)△H1 K1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2 K2
则2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=2△H2-△H1 (用△H1、△H2表示),该反应的化学平衡常数K=$\frac{{{K}_{2}}^{2}}{{K}_{1}}$(用K1、K2表示)
(2)汽车尾气转化反应:NO+CO→N2+CO2(未配平),将NO和CO转化为和N2 和CO2,实现除污,每生成1molN2还原剂失去电子数为4×6.02×1023.
(3)大气污染物氮氧化物可以用活性炭还原法处理.某研究小组向某2L的密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2 (g).在T1℃时,反应进行到不同时间测得各物质的物质的量如下:
| 时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 2.00 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
| CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是b(填字母编号).
a.加入一定量的活性炭 b.通入一定量的NO c.恒容时,充入一定量的氦气 d.加入合适的催化剂
(4)氨燃料电池使用的电解质溶液是2mol•L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O.放电时,该电池正极的电极反应式为O2+2H2O+4e-=4OH-.
(5)实验室中用NaOH溶液吸收CO2,发生反应为2CO2+3NaOH=Na2CO3+NaHCO3+H2O.所得混合液中所有离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则反应的H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前 v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3 的转化率小于80% |
 下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )
下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )| a | b | c | d | |
| ① | Si | SiO2 | H2SiO3 | Na2SiO3 |
| ② | N2 | NO | NO2 | HNO3 |
| ③ | Cu | CuO | Cu(OH)2 | CuSO4 |
| ④ | Na | NaCl | Na2CO3 | NaHCO3 |
| A. | ①② | B. | ②③ | C. | ③④ | D. | ② |

