题目内容
13.将1.4g氮气,1.6g氧气,4g氩气混合,则该混合气体在标准状况下的体积是( )| A. | 3.36 L | B. | 4.48 L | C. | 6.72 L | D. | 8.96 L |
分析 先根据n=$\frac{m}{M}$分别计算出三者的物质的量,标准状况下气体摩尔体积为22.4L/mol,然后根据V=nVm计算出标准状况下混合气体的体积.
解答 解:1.4g氮气的物质的量为:$\frac{1.4g}{28g/mol}$=0.05mol,
1.6g氧气的物质的量为:$\frac{1.6g}{32g/mol}$=0.05mol,
4g氩气的物质的量为:$\frac{4g}{40g/mol}$=0.1mol,
则混合气体的总物质的量为:0.05mol+0.05mol+0.1mol=0.2mol,
则混合气体在标准状况下气体摩尔体积为:22.4L/mol×0.2mol=4.48L,
故选B.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | 实验室制备Cl2,可用排饱和食盐水集气法收集 | |
| B. | 浓盐酸与KMnO4制氯气的离子方程式是:MnO4-+8H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+4H2O | |
| C. | 漂白粉溶液在空气中失效变化的离子方程式是:ClO-+CO2+H2O=HClO+HCO3- | |
| D. | H2O2具有很强的氧化性,在化学反应中只能作氧化剂 |
4.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 在同温同压时,相同体积的任何气体单质所含的原子数目相同 | |
| B. | 2 g 氢气所含原子数目为 NA | |
| C. | 在常温常压下,11.2 L 氮气所含的原子数目为 NA | |
| D. | 17 g 氨气所含电子数目为 10 NA |
1.CH3-CH=CH-CH3和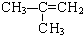 互为同分异构体,关于它们的性质叙述正确的是( )
互为同分异构体,关于它们的性质叙述正确的是( )
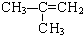 互为同分异构体,关于它们的性质叙述正确的是( )
互为同分异构体,关于它们的性质叙述正确的是( )| A. | 它们的分子式相同,物理性质相同 | |
| B. | 它们都具有碳碳双键,与H2加成的产物完全相同 | |
| C. | 它们都能使酸性高锰酸钾溶液褪色 | |
| D. | 它们都符合通式CnH2n-2 |
8.向含有下列某种阴离子的溶液中加入一小块钠,其离子数目会减少的是( )
| A. | CO32- | B. | HCO3- | C. | OH- | D. | Cl- |
2.下列氧化物中,加入水进一步反应生成相应物质的是( )
| A. | SiO2→H2SiO3 | B. | SO3→H2SO4 | C. | NO→HNO3 | D. | Al2O3→Al(OH)3 |
3.设NA为阿伏伽德罗常数的数值,下列叙述正确的是( )
| A. | 3.4g NH3中含有的电子数为0.2NA | |
| B. | 标准状况下,22.4L Cl2参加所有化学反应转移的电子数一定都是2NA | |
| C. | 标准状况下,0.5NA个HF分子所占的体积约为11.2L | |
| D. | 500mL 1mol/L氯化铁溶液中的Fe3+数小于0.5NA |
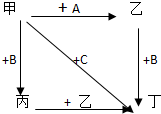 图中,乙是一种非金属单质,通常为黄绿色气体,A为一种黑色粉状固体,B是一种常见的金属单质,C是一种红褐色物质,它们之间存在如图关系:
图中,乙是一种非金属单质,通常为黄绿色气体,A为一种黑色粉状固体,B是一种常见的金属单质,C是一种红褐色物质,它们之间存在如图关系: