题目内容
6.下列离子方程式正确的是( )| A. | 将一定量KAl(SO4)2溶液和一定量Ba(OH)2溶液混合,沉淀的质量恰好最大时:Al3++2SO42-+3OH-+2Ba2+═2BaSO4↓+Al(OH)3↓ | |
| B. | 向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ | |
| D. | 用Al(OH)3中和过多的胃酸:Al(OH)3+3H+═Al3++3H2O |
分析 A.沉淀的质量恰好最大,即钡离子和硫酸离子恰好完全沉淀;
B.二者物质的量之比为1:2时,生成硫酸钡、硫酸钠和水;
C.电荷不守恒;
D.氢氧化铝与盐酸反应生成氯化铝和水.
解答 解:A.将一定量KAl(SO4)2溶液和一定量Ba(OH)2溶液混合,沉淀的质量恰好最大时:离子方程式为Al3++2SO42-+4OH-+2Ba2+=2BaSO4↓+AlO2-+2H2O,故A错误;
B.向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性,离子方程式:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故B错误;
C.FeCl3溶液与Cu的反应,离子方程式:Cu+2Fe3+═Cu2++2Fe2+,故C错误;
D.氢氧化铝与盐酸反应生成氯化铝和水,离子方程式:Al(OH)3+3H+═Al3++3H2O,故D正确;
故选:D.
点评 本题考查了离子方程式书写,明确反应实质是解题关键,注意反应物用量对反应的影响,题目难度不大.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
15.下列离子方程式中书写正确的是( )
| A. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 用氢氧化钡溶液中和硫酸溶液:Ba2++OH-+H++SO42-═H2O+BaSO4↓ | |
| C. | 氯化铝溶液中加入过量的氨水 Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 在澄清石灰水中通入过量的CO2:OH-+CO2═HCO3- |
1.某混合溶液中可能含有下列离子中的若干种:Na+、K+、Fe2+、Fe3+、SO42-、CO32- 现取三份该溶液进行如下实验:
(1)第一份加入足量盐酸,无任何气体产生;
(2)第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧、最后得到红棕色固体;
(3)第三份滴加0.1mol.L-1酸性KMnO4溶液,KMnO4溶液的紫色消失
(4)另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色.
根据上述实验,以下说法正确的是( )
(1)第一份加入足量盐酸,无任何气体产生;
(2)第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧、最后得到红棕色固体;
(3)第三份滴加0.1mol.L-1酸性KMnO4溶液,KMnO4溶液的紫色消失
(4)另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色.
根据上述实验,以下说法正确的是( )
| A. | 原混合溶液中只存在Na+、Fe3+、SO42-,不可能存在K+、CO32- | |
| B. | 由实验(1)无法推断原混合溶液中是否含有SO42- | |
| C. | 由实验(2)无法推断原混合溶液中是否含有Fe3+ | |
| D. | 由实验(3)可推断原混合溶液中存在Fe2+ |
18.用石墨电极电解1mol•L-1的下列溶液,溶液的pH不变的是( )
| A. | HCl | B. | NaOH | C. | Na2SO4 | D. | NaCl |
15.合成氨是基本无机化工,氨是化肥工业和有机化工的主要原料,也是一种常用的制冷剂.
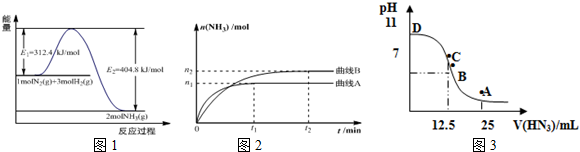
(1)图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图.
①下列说法正确的是BDE.
A.使用催化剂会使E1的数值增大
B.△H=-92.4kJ•mol-1
C.为了提高转化率,工业生产中反应的温度越低越好
D.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为$\frac{{n}_{1}}{4{t}_{1}}$mol•L-1•min-1
E.该反应的平衡常数KA<KB
F.图2是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
②下列能说明该反应达到平衡状态的是D
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v正(N2)=v逆(H2)
C.混合气体的密度保持不变
D.容器内压强保持不变
(2)合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K值和温度的关系如下:
400°C时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1时,此时刻该反应的v逆(N2)>v正(N2) (填“>”、“<”或“=”).
(3)常温下向25mL0.1mol/LNH3•H2O 溶液中,逐滴加入 0.2mol/L的HN3溶液,溶液的pH变化曲线如图3所示.
A、B、C、D 四个点中,水的电离程度最大的是C;A点时溶液中各离子浓度由小到大的顺序为c(OH-)<c(H+)<c(NH4+)<c(N3-).
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池.试写出该电池的正极反应式N2+8H++6e-═2NH4+.

(1)图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图.
①下列说法正确的是BDE.
A.使用催化剂会使E1的数值增大
B.△H=-92.4kJ•mol-1
C.为了提高转化率,工业生产中反应的温度越低越好
D.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为$\frac{{n}_{1}}{4{t}_{1}}$mol•L-1•min-1
E.该反应的平衡常数KA<KB
F.图2是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
②下列能说明该反应达到平衡状态的是D
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v正(N2)=v逆(H2)
C.混合气体的密度保持不变
D.容器内压强保持不变
(2)合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K值和温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
(3)常温下向25mL0.1mol/LNH3•H2O 溶液中,逐滴加入 0.2mol/L的HN3溶液,溶液的pH变化曲线如图3所示.
A、B、C、D 四个点中,水的电离程度最大的是C;A点时溶液中各离子浓度由小到大的顺序为c(OH-)<c(H+)<c(NH4+)<c(N3-).
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池.试写出该电池的正极反应式N2+8H++6e-═2NH4+.
16.某一海水资源利用的原理如图所示,下列有关说法正确的是( )
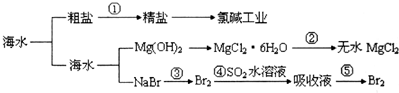

| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 工业上金属钠是通过氯碱工业制取的 | |
| C. | ④和⑤步的目的是为了浓缩 | |
| D. | 第③④⑤步中溴元素均被氧化 |