题目内容
13.已知下列热化学方程式:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1═-25kJ.mol-1
3Fe2O3(s)+CO(g)═2Fe3O4+CO2(g)△H2═-47kJ.mol-1
Fe3O4+CO(g)═3FeO(s)+CO2(g)△H3═+19kJ.mol-1
(1)计算FeO(s)+CO(g)═Fe(s)+CO2(g)反应的反应热△H=-11KJ/mol
(2)已知C(s)+$\frac{1}{2}$O2(g)═CO(g)
△H═-110.5kJ.mol-1,若还原FeO的CO是碳完全氧化而产生,则产生112gFe需C24g,整个过程中产生的热量为243KJ.
分析 (1)依据热化学方程式和盖斯定律计算得到FeO(s)+CO(g)═Fe(s)+CO2(g)反应的反应热;
(2)已知①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H═-110.5kJ.mol-1,
②FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11KJ/mol,
①+②得到FeO(s)+C(s)+$\frac{1}{2}$O2(g)═Fe(s)+CO2(g)△H=-121.5KJ/mol
依据此热化学方程式计算产生112gFe所需碳的物质的量和反应放出的热量;
解答 解:(1)已知下列热化学方程式:
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1═-25kJ.mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4+CO2(g)△H2═-47kJ.mol-1
③Fe3O4+CO(g)═3FeO(s)+CO2(g)△H3═+19kJ.mol-1
盖斯定律计算(①×3-②-③×2)×$\frac{1}{6}$得到FeO(s)+CO(g)═Fe(s)+CO2(g)反应的反应热△H=-11KJ/mol,
故答案为:-11KJ/mol;
(2)已知①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H═-110.5kJ.mol-1,
②FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11KJ/mol,
①+②得到FeO(s)+C(s)+$\frac{1}{2}$O2(g)═Fe(s)+CO2(g)△H=-121.5KJ/mol
产生112gFe物质的量=$\frac{112g}{56g/mol}$=2mol,需C物质的量2mol,碳的质量=2mol×12g/mol=24g,整个过程中产生的热量=121.5KJ/mol×2mol=243KJ,
故答案为:24;243KJ;
点评 本题考查了热化学方程式和盖斯定律的计算应用,主要是热化学方程式定量计算的方法分析,题目较简单.

| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 将一定量KAl(SO4)2溶液和一定量Ba(OH)2溶液混合,沉淀的质量恰好最大时:Al3++2SO42-+3OH-+2Ba2+═2BaSO4↓+Al(OH)3↓ | |
| B. | 向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ | |
| D. | 用Al(OH)3中和过多的胃酸:Al(OH)3+3H+═Al3++3H2O |
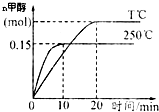 将1molCO和2molH2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol,根据图示判断,下列结论正确的是( )
将1molCO和2molH2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol,根据图示判断,下列结论正确的是( )| A. | a<0,T<250 | |
| B. | 250℃时,0~10min内:v(H2)=0.015mol/(L•min) | |
| C. | CO的平衡转化率在250℃时比T℃大 | |
| D. | 250℃时,起始时向容器中改充1molCH3OH气体,恒温达平衡后,CH3OH的物质的量大于0.15mol |
| A. | 氯化镁晶体需在氯化氢气流的氛围中加热失水制得无水氯化镁 | |
| B. | 夏天,打开碳酸饮料会有较多气泡溢出 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 工业上生产氨气时,采用高温和催化剂等条件 |


