题目内容
1.如表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.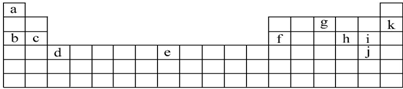
用元素符号回答下列问题:
(1)属于卤族元素的有Cl、Br;
(2)属于稀有气体元素的有Ne;
(3)属于碱金属元素的有Na;
(4)写出g元素的最高价氧化物对应的水化物的稀溶液与过量的铁反应的离子方程式:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O.
分析 由元素在周期表的位置可知,a为H,b为Na,c为Mg,f为Al,g为N,k为Ne,h为S,i为Cl,j为Br,d为Sc,e为Fe,
(1)位于第ⅤⅡA元素(或第17列)的为卤族元素;
(2)位于第18列的为稀有气体元素;
(3)位于第1列的为碱金属元素,H除外;
(4)g元素的最高价氧化物对应的水化物的稀溶液,为稀硝酸,与过量Fe反应生成硝酸亚铁、NO和水.
解答 解:由元素在周期表的位置可知,a为H,b为Na,c为Mg,f为Al,g为N,k为Ne,h为S,i为Cl,j为Br,d为Sc,e为Fe,
(1)属于卤族元素的有Cl、Br,故答案为:Cl、Br;
(2)属于稀有气体元素的有Ne,故答案为:Ne;
(3)属于碱金属元素的有Na,故答案为:Na;
(4)g元素的最高价氧化物对应的水化物的稀溶液,为稀硝酸,与过量Fe反应生成硝酸亚铁、NO和水,离子反应为3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,
故答案为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素化合物知识等为解答的关键,侧重分析与应用能力的考查,注意元素的位置及族的名称,题目难度不大.

练习册系列答案
相关题目
15.有关化学用语正确的是( )
| A. | 乙烯的实验式C2H4 | B. | 乙醇的结构简式C2H6O | ||
| C. | 四氯化碳的电子式  | D. | 臭氧的分子式O3 |
20.①-⑧均为短周期元素,根据表中数据判断下列说法不正确的是( )
| 编号 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.89 | |
| 主 要 化 合 价 | 最高价 | +2 | +1 | +5 | +7 | +1 | +5 | +2 | |
| 最低价 | -2 | -3 | -1 | -3 | |||||
| A. | ③和⑥、④和⑦分别处于同一主族 | |
| B. | 元素④处于第3周期ⅤA族 | |
| C. | 元素⑥对应的氢氧化物是强碱 | |
| D. | 元素①与元素⑥形成的化合物中不可能存在共价键 |
6.已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验.请回答相关问题.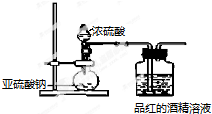
(1)为了探究干燥的SO2能不能使品红褪色,某同学设计了如右图所示实验装置,请指出实验装置图设计中的不合理之处.
①二氧化硫没有干燥(或缺少二氧化硫的干燥装置);
②没有尾气吸收装置.
(2)按照修改后的装置,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.这说明品红褪色的原因不是二氧化硫直接导致.为此,SO2能使品红的水溶液褪色的可能微粒有H2SO3、HSO3-、SO3 2-.
(3)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,对此,他得出结论:使品红褪色的微粒是HSO${\;}_{3}^{-}$和SO${\;}_{3}^{2-}$,不是H2SO3.你认为他的结论是否正确不正确,其理由是因亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸.
(4)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20mL.于两只小烧杯中,两只烧杯中同时一次性各加入 20mL 0.1mol/L的亚硫酸钠,20mL 0.1mol/L的亚硫酸氢钠溶液,发现加入亚硫酸钠溶液的品红褪色较快.
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“此空删去”内容..
②根据实验和分析,该同学得出的结论是主要是SO32-有漂白作用.

(1)为了探究干燥的SO2能不能使品红褪色,某同学设计了如右图所示实验装置,请指出实验装置图设计中的不合理之处.
①二氧化硫没有干燥(或缺少二氧化硫的干燥装置);
②没有尾气吸收装置.
(2)按照修改后的装置,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.这说明品红褪色的原因不是二氧化硫直接导致.为此,SO2能使品红的水溶液褪色的可能微粒有H2SO3、HSO3-、SO3 2-.
(3)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,对此,他得出结论:使品红褪色的微粒是HSO${\;}_{3}^{-}$和SO${\;}_{3}^{2-}$,不是H2SO3.你认为他的结论是否正确不正确,其理由是因亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸.
(4)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20mL.于两只小烧杯中,两只烧杯中同时一次性各加入 20mL 0.1mol/L的亚硫酸钠,20mL 0.1mol/L的亚硫酸氢钠溶液,发现加入亚硫酸钠溶液的品红褪色较快.
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“此空删去”内容..
| 同浓度溶液 | SO${\;}_{3}^{2-}$ | HSO${\;}_{3}^{-}$ | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 较上面少 | 较上面多 | 较上面多 | 慢 |
 ,反应类型取代反应
,反应类型取代反应