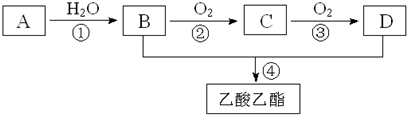
题目内容
16.写出实验现象,按要求写反应式.(1)向FeCl2溶液中加双氧水,现象为淡绿色溶液转变棕黄色溶液,离子方程式2Fe2++2H++H2O2=2Fe3++2H2O.
(2)向FeCl3溶液中加入金属钠,现象为有无色无味气体产生,有红褐色沉淀生成,离子方程式2Na+2H2O=2Na++2OH-+H2↑、Fe3++3OH-=Fe(OH)3↓(或2Fe3++6Na+6H2O=Fe(OH)3↓+3H2↑+6Na+).
分析 (1)双氧水具有氧化性,可氧化亚铁离子;
(2)钠和水反应生成氢氧化钠,氢氧化钠和氯化铁反应生成氢氧化铁沉淀.
解答 解:(1)双氧水具有氧化性,可氧化亚铁离子,反应的离子方程式为2 Fe2++2H ++H2O2=2 Fe3++2H2O,可观察到淡绿色溶液转变棕黄色溶液,
故答案为:淡绿色溶液转变棕黄色溶液;2 Fe2++2H ++H2O2=2 Fe3++2H2O;
(2)钠和水反应生成氢氧化钠,氢氧化钠和氯化铁反应生成氢氧化铁沉淀,可观察到有无色无味气体产生,有红褐色沉淀生成,相关的离子方程式为2Na+2H2O=2Na++2OH -+H2↑、Fe3++3OH -=Fe(OH)3↓(或2Fe3++6Na+6H2O=Fe(OH)3↓+3H2↑+6 Na+),
故答案为:有无色无味气体产生,有红褐色沉淀生成;2Na+2H2O=2Na++2OH -+H2↑、Fe3++3OH -=Fe(OH)3↓(或2Fe3++6Na+6H2O=Fe(OH)3↓+3H2↑+6 Na+).
点评 本题考查元素化合物知识以及离子方程式的书写,为高频考点,侧重于学生的分析能力的考查,注意把握物质的相关性质以及离子方程式的书写方法,难度不大.

练习册系列答案
相关题目
6.下列关于可逆反应是否达到平衡状态的说法中不正确的是( )
| A. | 对于反应2AB(g)?A2(g)+B2(g),当容器中AB与A2的体积比不随时间变化,说明反应一定达到平衡状态 | |
| B. | 对于反应N2(g)+3H2(g)?2NH3(g),当1个N≡N键断裂的同时3个H-H键形成,说明反应一定达到平衡状态 | |
| C. | 在恒温,恒容密闭容器中如下反应:2HI(g)?H2(g)+I2(g)混合气体颜色不在变化,说明反应一定达到平衡 | |
| D. | 在恒温,恒容密闭容器中如下反应:X2(g)+Y2(g)?2Z(g)+W(s),当混合气体的平均相对分子质量或压强不随时间的变化而变化,说明反应一定达到平衡 |
7.下列事实中,不能说明HR是弱酸的是( )
| A. | 0.1mol/L HR溶液与0.1mol/L氨水等体积反应,所得溶液呈酸性 | |
| B. | NaR晶体用蒸馏水配成水溶液,PH试纸测得PH大于7 | |
| C. | 将PH=2.3的HR溶液加蒸馏水稀释10倍,PH变成2.8 | |
| D. | 常温下,0.1mol/L HR溶液的pH为2 |
4.对于反应2SO2(g)+O2(g)?2SO3(g),一次只改变一个条件,能增大逆反应速率的措施是( )
| A. | 增大容器体积 | B. | 通入大量O2 | C. | 移去部分SO2 | D. | 降低体系温度 |
11.下列过程中不涉及化学变化的是( )
| A. | 粮食酿酒 | B. | 用食醋除去水壶中的水垢 | ||
| C. | 用木炭除去冰箱中的异味 | D. | 苹果腐烂 |
2.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 常温常压下,32 g O2含有氧原子数为NA | |
| B. | 标准状况下,22.4 L H2O含有的分子数为NA | |
| C. | 18g H2O中含有的电子数为10NA | |
| D. | 0.5mol•L-1CaCl2溶液中含Cl-数目为NA |