题目内容
在密闭容器中发生如下反应:aX(g)+bY(g)?cZ(g)+dW(g),反应达平衡后,W的浓度为0.5mol?L-1,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为0.8mol?L-1.下列叙述不正确的是( )
| A、平衡向逆反应方向移动 |
| B、a+b>c+d |
| C、Z的体积分数减少 |
| D、X的转化率减小 |
考点:化学平衡的计算
专题:
分析:平衡时W的浓度为0.5mol?L-1,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,若平衡不移动,则W的浓度应增大为1.0mol?L-1,而此时为0.8mol?L-1,则说明增大压强平衡向正方向移动,以此进行判断.
解答:
解:平衡时W的浓度为0.5mol?L-1,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,若平衡不移动,则W的浓度应增大为1.0mol?L-1,而此时为0.8mol?L-1,则说明增大压强平衡向正方向移动,
A、由分析可知平衡向正反应方向移动,故A错误;
B、增大压强平衡向正方向移动,说明反应物气体的计量数之和大于生成物气体的计量数,应为a+b>c+d,故B正确;
C、平衡向正方向移动,Z的体积分数增大,故C错误;
D、平衡向正方向移动,X的转化率增大,故D错误;
故选:B.
A、由分析可知平衡向正反应方向移动,故A错误;
B、增大压强平衡向正方向移动,说明反应物气体的计量数之和大于生成物气体的计量数,应为a+b>c+d,故B正确;
C、平衡向正方向移动,Z的体积分数增大,故C错误;
D、平衡向正方向移动,X的转化率增大,故D错误;
故选:B.
点评:本题考查化学平衡移动知识,题目难度不大,注意从浓度的变化的角度判断平衡移动的方向,结合压强对平衡移动的影响分析.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
下列有机物的命名中,不正确的是( )
| A、4-甲基-3-乙基-2-己烯 |
| B、3-甲基-3-乙基戊烷 |
| C、3,3-二甲基丁烷 |
| D、3-甲基苯乙烯 |
若液氨相当于地球上的水,它可满足木星上生物生存的需要,那么木星上生物体内与地球上生物体内葡萄糖的分子结构相当的化合物是( )
| A、CH2OH-(CHOH)4CHO |
| B、CH2NH2-(CHNH2)4CHO |
| C、CH2NH2-(CHNH2)4CH=NH |
| D、CH2OH-(CHOH)4CH=NH |
用括号中的试剂除去各组物质中的少量杂质正确的是( )
| A、苯中的甲苯(溴水) |
| B、乙醇中的乙酸(NaOH溶液) |
| C、溴苯中的溴(KI溶液) |
| D、乙醇中的水(新制的CaO) |
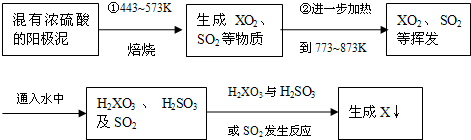

 某学习小组利用教材中的装置(如图1)进行铜与浓硫酸的反应,实验中发现了3个问题:(ⅰ)没有尾气处理装置;(ⅱ)品红溶液产生倒吸;(ⅲ)试管内生成了白色固体,铜丝表面还有黑色固体.针对以上问题,学习小组进行了如下改进与探究.
某学习小组利用教材中的装置(如图1)进行铜与浓硫酸的反应,实验中发现了3个问题:(ⅰ)没有尾气处理装置;(ⅱ)品红溶液产生倒吸;(ⅲ)试管内生成了白色固体,铜丝表面还有黑色固体.针对以上问题,学习小组进行了如下改进与探究.