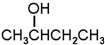题目内容
溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质.实验室用工业大理石(含有少量 Al3+,Fe3+杂质)制备溴化钙的主要流程如下:完成下列填空:

提示:25℃时,Al(OH)3、Fe(OH)3,沉淀与pH关系如下:
(1)上述适用的氢溴酸的质量分数为26%,若用47%的氢溴酸配制26%的氢溴酸500ml,所需的玻璃仪器有玻璃棒、量筒、胶头滴管、烧杯、 .
(2)请写出步骤Ⅰ中大理石与氢溴酸反应的离子方程式 .
(3)已知步骤Ⅲ的滤液中不含NH4+,步骤Ⅱ加入的试剂a是 (写化学式);为了使Al3+、Fe3+恰好沉淀完全,应控制溶液的PH大于 .
(4)制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品.②溶解.③滴入足量Na2CO3溶液,充分反应后过滤.④洗涤、干燥.⑤称量
①若得到1.88g碳酸钙,则溴化钙的质量分数为
②请设计实验方案判断④中洗涤是否完全 .

提示:25℃时,Al(OH)3、Fe(OH)3,沉淀与pH关系如下:
| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀的PH | 3.1 | 2.3 |
| 沉淀完全的 PH | 5.3 | 3.7 |
(2)请写出步骤Ⅰ中大理石与氢溴酸反应的离子方程式
(3)已知步骤Ⅲ的滤液中不含NH4+,步骤Ⅱ加入的试剂a是
(4)制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品.②溶解.③滴入足量Na2CO3溶液,充分反应后过滤.④洗涤、干燥.⑤称量
①若得到1.88g碳酸钙,则溴化钙的质量分数为
②请设计实验方案判断④中洗涤是否完全
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)用浓溶液配制500mL稀溶液,因此需要量筒取经过计算需要的浓溶液的体积,然后在烧杯中溶解、配制500mL溶液,需要500mL容量瓶;
(2)氢溴酸为强酸,写出与碳酸钙反应的离子方程式;
(3)加入的试剂a、控制溶液的pH以达到除去杂质Al3+、Fe3+的目的、防止氢氧化铝溶解的目的,因此a是碱,根据题意及不引入新的杂质可知是氢氧化钙;则控制pH应大于5.3;
(4)①根据Ca元素守恒,根据得到的1.88g碳酸钙,可求得样品中溴化钙的质量,从而计算出质量分数;
②洗涤完全说明洗涤液中不含Na2CO3溶液,采用检验碳酸根离子的方式进行验证.
(2)氢溴酸为强酸,写出与碳酸钙反应的离子方程式;
(3)加入的试剂a、控制溶液的pH以达到除去杂质Al3+、Fe3+的目的、防止氢氧化铝溶解的目的,因此a是碱,根据题意及不引入新的杂质可知是氢氧化钙;则控制pH应大于5.3;
(4)①根据Ca元素守恒,根据得到的1.88g碳酸钙,可求得样品中溴化钙的质量,从而计算出质量分数;
②洗涤完全说明洗涤液中不含Na2CO3溶液,采用检验碳酸根离子的方式进行验证.
解答:
解:(1)用浓溶液配制500mL稀溶液,因此需要量筒取经过计算需要的浓溶液的体积,然后在烧杯中溶解、配制500mL溶液,需要500mL容量瓶,故答案为:500mL容量瓶;
(2)氢溴酸为强酸,写出与碳酸钙反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(3)加入的试剂a、控制溶液的pH以达到除去杂质Al3+、Fe3+的目的、防止氢氧化铝溶解的目的,因此a是碱,根据题意及不引入新的杂质可知是氢氧化钙;则控制pH应大于5.3;故答案为:Ca(OH)2,5.3;
(4)①根据元素守恒CaBr2~CaCO3
200 100
3.76g 1.88g
可求CaBr2的质量为3.76g,则质量分数为:
=0.94,故答案为:0.94;
②洗涤完全说明洗涤液中不含Na2CO3溶液,采用检验碳酸根离子的方式进行验证,故答案为:取最后一次洗涤液少许于试管中,向试管中滴入适量氯化钙溶液,如无现象,则洗涤完全,如有沉淀生成,则洗涤不完全.
(2)氢溴酸为强酸,写出与碳酸钙反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(3)加入的试剂a、控制溶液的pH以达到除去杂质Al3+、Fe3+的目的、防止氢氧化铝溶解的目的,因此a是碱,根据题意及不引入新的杂质可知是氢氧化钙;则控制pH应大于5.3;故答案为:Ca(OH)2,5.3;
(4)①根据元素守恒CaBr2~CaCO3
200 100
3.76g 1.88g
可求CaBr2的质量为3.76g,则质量分数为:
| 3.76g |
| 4.00g |
②洗涤完全说明洗涤液中不含Na2CO3溶液,采用检验碳酸根离子的方式进行验证,故答案为:取最后一次洗涤液少许于试管中,向试管中滴入适量氯化钙溶液,如无现象,则洗涤完全,如有沉淀生成,则洗涤不完全.
点评:本题主要考查物质的分离与提纯,做题时注意审题,应清楚的认识操作流程,掌握基本实验操作.

练习册系列答案
相关题目
将铁片加到1L 0.5mol?L-1 FeCl3溶液中,当Fe2+和Fe3+的浓度相等时,铁片的质量为( )
| A、2.8g | B、5.6g |
| C、11.2g | D、1.4g |
下列关于乙酸的说法不正确的是( )
| A、乙酸分子中含有碳氧双键,所以乙酸能使酸性高锰酸钾溶液褪色 |
| B、乙酸俗称醋酸,无水乙酸又称为冰醋酸,它是纯净物 |
| C、乙酸是重要的有机酸,是一种有刺激性气味的液体 |
| D、可以用乙酸除去热水瓶中的水垢 |
在密闭容器中发生如下反应:aX(g)+bY(g)?cZ(g)+dW(g),反应达平衡后,W的浓度为0.5mol?L-1,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为0.8mol?L-1.下列叙述不正确的是( )
| A、平衡向逆反应方向移动 |
| B、a+b>c+d |
| C、Z的体积分数减少 |
| D、X的转化率减小 |
可用于鉴别氯化钾、盐酸、氢氧化钾三种溶液的试剂是( )
| A、AgNO3溶液 |
| B、紫色石蕊试液 |
| C、Na2CO3溶液 |
| D、淀粉碘化钾溶液 |
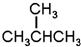 G.
G.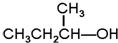 和
和