题目内容
2.资料卡片:溴在水中溶解度不大(稀溴水呈黄色),易溶于CCl4等有机溶剂.某校化学实验兴趣小组在“探究Cl2、Br2的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生氧化还原反应所致,则溶液呈黄色是含Br2(填化学式)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生氧化还原反应所致,则溶液呈黄色是含Fe3+(填离子符号)所致.
(3)设计实验并验证:丙同学为验证乙同学的观点,利用下列提供的试剂,设计出一种方案进行了实验,并通过观察现象,得出乙同学的观点正确.供选用的试剂:酚酞、CCl4、无水酒精、KSCN溶液、蒸馏水等.请你写出丙同学选用的试剂是KSCN溶液,实验中观察到的现象是溶液显红色.
(4)结论:氧化性:Br2>Fe3+在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生反应的离子方程式是2Fe2++Br2=2Fe3++2Br-.
(5)实验后的思考:根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是Fe2+(填离子符号).
分析 (2)Fe2+的颜色:浅绿色,Fe3+的颜色:棕黄色,溴水的颜色:橙黄色.根据题意在足量的氯化亚铁溶液中加入l-2滴溴水,如果不发生氧化还原反应,溶液呈黄色是由溴水引起的,如果发生反应:2 Fe2++Br2═2Fe3++2Br-,生成Fe3+,溶液呈黄色是由Fe3+引起的.即可得出甲同学、乙同学的结论;
(3)乙同学的观点认为氧化性:Fe3+<Br2,则会发生反应:2 Fe2++Br2═2 Fe3++2Br-,要设计方案进行实验证明乙同学的观点确实正确,考虑两种思路.第一,溶液中不存在Br2,然后选择合适试剂检验不存在Br2.第二,溶液中存在Fe3+,选择合适试剂检验存在Fe3+.即可确定乙同学观点正确;
(4)溴单质具有氧化性,可以将亚铁离子氧化为三价;
(5)还原性较强的离子先被氧化剂氧化.
解答 解:(2)Fe2+的颜色:浅绿色,Fe3+的颜色:棕黄色,溴水的颜色:橙黄色.
根据题意在足量的氯化亚铁溶液中加入l-2滴溴水,若Fe3+氧化性强于Br2,则不发生氧化还原反应,溶液呈黄色是由加入溴水引起的;如果Br2氧化性强于Fe3+,则发生反应:2Fe2++Br2═2 Fe3++2Br-,生成了Fe3+,则溶液呈黄色是由Fe3+引起的.因此①中甲同学认为氧化性:Fe3+>Br2,不发生反应,溶液呈黄色是由溴水引起的;②中乙同学认为氧化性:Fe3+<Br2,发生反应生成Fe3+,溶液呈黄色是由Fe3+引起的,
故答案为:Br2;Fe3+;
(3)在足量的稀氯化亚铁溶液中,加入1~2滴溴水,检验亚铁离子是否被溴单质氧化,可以用KSCN溶液检验三价铁离子是否生成,如果加入KSCN溶液显红色,证明三价铁生成了,乙同学的观点正确,故答案为:KSCN溶液;溶液显红色;
(4)溴单质具有氧化性,可以将亚铁离子氧化为三价,实质是:2Fe2++Br2=2Fe3++2Br-,故答案为:2Fe2++Br2=2Fe3++2Br-;
(5)根据上述实验推测,氧化性顺序是:氯气>溴单质>三价铁离子,亚铁离子还原性强于溴离子,所以先被氧化的是Fe2+,故答案为:Fe2+.
点评 本题考查氧化还原反应基础知识,联系元素及其化合物,设计探究实验,判断氧化性、还原性的强弱.需具备一定的实验能力和综合思维能力,尤其是氧化性、还原性强弱的判断及根据量的不同书写离子方程式,非常容易出错,需要注意多练习.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(1)O2-的电子式为
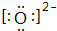 ;
;(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例O3、Cl2(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是甲醇分子之间能形成氢键,而乙烷不能;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是Fe(或者FeCl3)能催化苯与氯气的反应.
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3.当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于1:2.
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物.已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体.该气体被溴水全部吸收后,溴水增重2.6g.请写出该水解反应方程式MgC2+2H2O=Mg(OH)2+C2H2↑.
| A. | CDEBA | B. | ECDAB | C. | BAEDC | D. | CDBAE |
| A. | 上述反应中硫元素只被氧化 | |
| B. | Na2S2O3在强酸性环境中能稳定存在 | |
| C. | 每生成1 molNa2S2O3,转移电子数为4NA | |
| D. | 若将Na2CO3换成Na2SO3(配比不变),每吸收3 molSO2,理论上就会生成3mol Na2S2O3 |
【探究目的】探究该焰火原料的组成
【资料检索】①Mg2+检验方法:取2滴待检液,加入2滴2mol•L-1NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚).若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+.但Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+检出
②Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵
③很多合金是金属互化物,有确定的化学组成
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式
【实验探究】(1)甲同学进行了初步试验,实验步骤和实验现象如下.请填写下表.
| 试验序号 | 实 验 步 骤 | 实 验 现 象 | 结 论 |
| ① | 取少量该焰火原料加入冷水 | 无明显现象 | 不含Li、Na等活泼金属 |
| ② | 取少量该焰火原料加入稀盐酸 | 完全溶解,有大量气体产生,溶液呈无色 | 可能含铍(Be)、镁(Mg)、铝(Al)三种金属中的任意两种 |
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下.
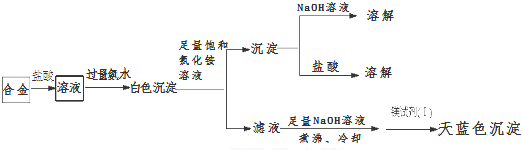
由丙的实验记录可知,该焰火原料是由Mg和Al两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸,煮沸的理由是将NH4+转化为NH3,煮沸促进氨气逸出,防止NH4+干扰Mg2+的检验.
(4)丁同学利用丙同学的结论,设计如下图所示的实验步骤,确定合金组成.

问题讨论:
①能确定合金组成的数据组有a、b、c(填写选项字母);
A.m、n B.m、y C.n、y
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,试在右图中作出y随x变化的曲线;
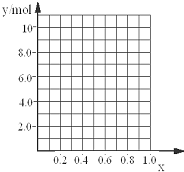
③当y=8.5mol时,该合金是一种金属互化物,其化学式为Mg4Al3.
| A. | 铁投入硫酸锌溶液中:Fe+Zn2+═Zn+Fe2+ | |
| B. | 钠投入硫酸铜溶液中:2Na+Cu2+═Cu+2Na+ | |
| C. | 往饱和Na2CO3溶液中逐滴加入少量稀盐酸:$CO_3^{2-}$+2H+═CO2↑+H2O | |
| D. | 钠投入冷水中:2Na+2H2O═2Na++2OH-+H2↑ |
| A. | 常温常压下,22.4L乙烯中C-H键数为4NA | |
| B. | 1L 0.1mol•L-1乙酸溶液中H+数为0.1NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
 某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.
某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.