题目内容
如图中每一方格表示有关的一种反应物或生成物.其中A、C为无色气体.
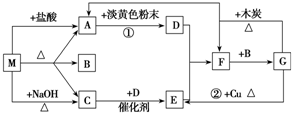
请回答下列问题:
(1)物质M可以是 或 ,C是 ,F是 .
(2)淡黄色粉末的电子式是 .
(3)反应①的化学方程式 .
(4)反应②的离子方程式 .
(5)G-→A+F的化学方程式 .

请回答下列问题:
(1)物质M可以是
(2)淡黄色粉末的电子式是
(3)反应①的化学方程式
(4)反应②的离子方程式
(5)G-→A+F的化学方程式
考点:无机物的推断
专题:
分析:M既能与盐酸反应,又能与NaOH反应,都生成气体,应为弱酸铵盐,则C为NH3,气体A能与淡黄色粉末反应,应是二氧化碳与过氧化钠反应,故A为CO2,则A应为碳酸铵或碳酸氢铵,B为H2O,结合转化关系可知,D为O2,E为NO,F为NO2,G为HNO3,以此解答该题.
解答:
解:M既能与盐酸反应,又能与NaOH反应,都生成气体,应为弱酸铵盐,则C为NH3,气体A能与淡黄色粉末反应,应是二氧化碳与过氧化钠反应,故A为CO2,则A应为碳酸铵或碳酸氢铵,B为H2O,结合转化关系可知,D为O2,E为NO,F为NO2,G为HNO3,
(1)由上述分析可知,M为(NH4)2CO3 或NH4HCO3,C为NH3,F为NO2,
故答案为:(NH4)2CO3 或NH4HCO3;NH3;NO2;
(2)淡黄色粉末为过氧化钠,其电子式为: ,故答案为:
,故答案为: ;
;
(3)反应①为二氧化碳和过氧化钠的反应,反应方程式为2Na2O2+2CO2═2Na2CO3+O2;
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(4)反应②是铜和稀硝酸反应生成硝酸铜、一氧化氮和水,离子方程式为:3Cu+8H++2N03-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2N03-=3Cu2++2NO↑+4H2O;
(5)G→A+F的化学方程式为C+4HNO3
4NO2↑+CO2↑+2H2O,故答案为:C+4HNO3
4NO2↑+CO2↑+2H2O.
(1)由上述分析可知,M为(NH4)2CO3 或NH4HCO3,C为NH3,F为NO2,
故答案为:(NH4)2CO3 或NH4HCO3;NH3;NO2;
(2)淡黄色粉末为过氧化钠,其电子式为:
 ,故答案为:
,故答案为: ;
;(3)反应①为二氧化碳和过氧化钠的反应,反应方程式为2Na2O2+2CO2═2Na2CO3+O2;
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(4)反应②是铜和稀硝酸反应生成硝酸铜、一氧化氮和水,离子方程式为:3Cu+8H++2N03-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2N03-=3Cu2++2NO↑+4H2O;
(5)G→A+F的化学方程式为C+4HNO3
| ||
| ||
点评:本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,注意M能与酸、碱反应生成气体A、C为解答本题的突破口,然后利用转化关系推出各物质,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
生产、生活中离不开各类化学物质.下列物质中属于盐类的是( )
| A、生石灰 | B、硫酸 |
| C、硫酸镁 | D、酒精 |
溶液中氧化剂XO3-的含量有3×10-2mol,与300mL 0.2mol?L-1亚硫酸钠(Na2SO3)溶液恰好反应完全,已知Na2SO3被氧化为Na2SO4,则还原产物中元素X的价态是( )
| A、+2 | B、-2 | C、+1 | D、0 |
化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是( )


| A、化学反应中能量变化的主要原因是化学键的断裂与生成 |
| B、化学反应中的能量变化都表现为热量变化 |
| C、图I所示的装置能将化学能转变为电能 |
| D、图II所示的反应为吸热反应 |
设NA表示阿伏加德罗常数,下列说法正确的是( )
| A、1L 1mol/L的FeCl3液中含Fe3+的数目为NA |
| B、室温下,21.0g乙烯和丁烯的混合气体中含有的子数目为1.5NA |
| C、标准状况下,2.24LCl2与足量稀NaOH溶液反应,转移的电子总数为0.2NA |
| D、18gNH4-中含有的质子数为0.1NA |
下列各组离子一定能大量共存的是( )
| A、加入KSCN溶液显血红色的溶液中:Fe2+、Mg2+、Cl-、SO42- |
| B、能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、Fe2+ |
| C、常温下水电离出的c(H+)?c(OH-)=10-20 (mol?L-1)2的溶液中:Na+、ClO-、S2-、NH4+ |
| D、在AlCl3溶液中,Na+、AlO2-、NO3-、SO42- |

