题目内容
16.将盛有N2和NO2的混合气体的试管倒立于水中经过足够时间后,气体体积减少为原来的$\frac{3}{4}$,则原混合气体中N2和NO2的体积比是( )| A. | 1:1 | B. | 1:2 | C. | 5:3 | D. | 3:2 |
分析 NO2和N2的混合气体通入倒立于水槽中盛满水的试管中,发生反应3NO2+H2O=2HNO3+NO,设NO2体积为b气体减少的体积$\frac{2}{3}$b,剩余气体体积为a+$\frac{1}{3}$b,根据剩余气体为原来的$\frac{3}{4}$可以推出原混合气体中N2和NO2的体积比例.
解答 解:设原混合气体中N2的体积为a,NO2的体积为b,
发生反应3NO2+H2O=2HNO3+NO,
b $\frac{1}{3}$b
根据剩余气体体积为原来的$\frac{3}{4}$,可以得到:$\frac{a+\frac{1}{3}b}{a+b}$=$\frac{3}{4}$,所以a:b=5:3
所以原混合气体中N2和NO2的体积比是5:3,
故选C.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的化学反应及差量法计算为解答的关键,注意氮的氧化性的性质,题目难度不大.

练习册系列答案
相关题目
6.下列物质溶于水后由于水解而显酸性的是( )
| A. | NaHSO4 | B. | NaHCO3 | C. | FeCl3 | D. | CH3COOH |
7.下列说法中正确的是( )
| A. | 6.8 g熔融KHSO4 与3.9 g熔融Na2O2 中阴离子数目相同 | |
| B. | 某金属阳离子的结构示意图为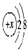 ,其与Cl-形成的强电解质都是离子化合物 ,其与Cl-形成的强电解质都是离子化合物 | |
| C. | 二硫化碳与二氧化碳结构相似,其电子式为 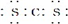 | |
| D. | 中子数为18的氯原子可表示为18Cl |
11.下列说法不正确的是( )
| A. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 金属材料都是导体,非金属材料都是绝缘体 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 我国规定自2008年6月1日起,商家不得无偿提供塑料袋,目的是减少“白色污染” |
1.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | NA个N2分子与NA个CO分子的质量比为1﹕1 | |
| B. | 水的摩尔质量等于NA个水分子的质量 | |
| C. | 在常温常压下,11.2LSO2含有的分子数为0.5NA | |
| D. | 1L 0.1mol•L-1Na2SO4溶液中有0.1NA个Na+ |
8.一定量的某有机物完全燃烧,生成0.2mol CO2和5.4g H2O,该有机物不可能是( )
| A. | CH≡CH | B. | CH3CH3 | C. | CH3CH2OH | D. | CH3OCH3 |
6.已知某有机物分子中H原子个数为偶数,若将2.25克该有机物在足量氧气中完全燃烧,得到4.4克CO2和2.25克的H2O,则下列说法不正确的是( )
| A. | 可以确定该有机物的相对分子量为90 | |
| B. | 可以确定该有机物的分子式为C4H10O2 | |
| C. | 该有机物中碳、氢、原子个数比为2:5:1 | |
| D. | 因为不知道其相对分子量,故无法确定其分子式 |