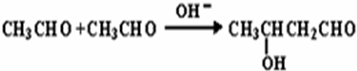题目内容
下列溶液中Cl-的物质的量浓度与100mL 2mol?L-1MgCl2溶液中Cl-的浓度相等的是( )
| A、150 mL 4mol?L-1NaCl溶液 |
| B、75 mL 1mol?L-1AlCl3溶液 |
| C、75 mL 3mol?L-1CaCl2溶液 |
| D、200 mL 2mol?L-1KCl溶液 |
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:根据同一化学式中各微粒的浓度等于物质的物质的量浓度×离子个数,与溶液的体积无关,100mL 2mol?L-1 MgCl2溶液中Cl-物质的量浓度为4mol/L,以此解答.
解答:
解:100mL 2mol?L-1MgCl2溶液中Cl-的浓度为4mol/L,
A.150 mL 4mol?L-1NaCl溶液中Cl-的浓度为4mol/L,故A正确;
B.75 mL 1mol?L-1AlCl3溶液中Cl-的浓度为3mol/L,故B错误;
C.75 mL 3mol?L-1CaCl2溶液中Cl-的浓度为6mol/L,故C错误;
D.200 mL 2mol?L-1KCl溶液中Cl-的浓度为2mol/L,故D错误.
故选A.
A.150 mL 4mol?L-1NaCl溶液中Cl-的浓度为4mol/L,故A正确;
B.75 mL 1mol?L-1AlCl3溶液中Cl-的浓度为3mol/L,故B错误;
C.75 mL 3mol?L-1CaCl2溶液中Cl-的浓度为6mol/L,故C错误;
D.200 mL 2mol?L-1KCl溶液中Cl-的浓度为2mol/L,故D错误.
故选A.
点评:本题考查物质的量浓度的计算与理解,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
近期陆续曝光了一些制药企业为了谋求暴利,用经生石灰处理过的皮革废料,熬制成工业明胶,制成药用胶囊.下列说法错误的是( )
| A、工业明胶是一种从动物的结缔或表皮组织中的胶原部分水解出来的蛋白质,其制备过程中因混有杂质,经常显现出鲜艳的颜色,因此可以将其作为食品添加剂中的着色剂使用 |
| B、此次曝光出的毒胶囊中有大家熟悉的阿莫西林胶囊.阿莫西林是一种最常用的青霉素类广谱抗生素.病人在使用青霉素前一定要进行皮试 |
| C、皮革在工业加工时,要使用含铬的鞣制剂,因此往往会造成铬含量的严重超标.重金属铬可使人体内的蛋白质变性 |
| D、生石灰与水的反应产物俗称熟石灰,其在工业生产上有很多用途,如治理酸性废水、制取漂白粉等 |
下列热化学方程式中,正确的是( )
| A、甲烷的燃烧热为890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 |
| B、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ?mol-1 |
| C、HCl和NaOH反应的中和热△H=-57.3 kJ?mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 |
| D、在101 kPa时,2gH2完全燃烧生成液态水,放出285.8lkJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ?mol-1 |
下列叙述正确的是( )
| A、1 mol H2O的质量为18g/mol |
| B、3.01×1023个SO2分子的质量为32g |
| C、CH4的摩尔质量为16g |
| D、标准状况下,1 mol任何物质的体积均为22.4L |
设NA表示阿伏加德罗常数的数值,则下列说法正确的是( )
| A、标准状况下,4.48L水中含有的分子数目为0.2NA |
| B、0.1mol钠与足量水反应转移的电子数目为0.1NA |
| C、0.2mol?L-1CuSO4溶液中含有的SO42-离子数目为0.2NA |
| D、0.5molKClO3中含有Cl-的数目为0.5NA |
下列叙述正确的是( )
| A、离子化合物中只存在阴、阳离子之间的静电作用 |
| B、相同质量的N2、N4、N30含有的分子数相同 |
| C、23g钠和足量水反应失去6.02×1023个电子 |
| D、当1molCl2的体积为22.4L时,该氯气一定处于标准状况下 |
 条件一定时,反应2A(g)+B(g)?2C(g),B的转化率α与温度T变化关系曲线图如图所示,图中4个点中,表示未达到平衡状态,且V正<V逆的点是( )
条件一定时,反应2A(g)+B(g)?2C(g),B的转化率α与温度T变化关系曲线图如图所示,图中4个点中,表示未达到平衡状态,且V正<V逆的点是( ) 氯是一种非常重要的非金属元素.
氯是一种非常重要的非金属元素.