题目内容
设NA表示阿伏加德罗常数的数值,则下列说法正确的是( )
| A、标准状况下,4.48L水中含有的分子数目为0.2NA |
| B、0.1mol钠与足量水反应转移的电子数目为0.1NA |
| C、0.2mol?L-1CuSO4溶液中含有的SO42-离子数目为0.2NA |
| D、0.5molKClO3中含有Cl-的数目为0.5NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.由于标准状况下,水是液体,无法求算其物质的量;
B.钠原子反应失去一个电子,0.1mol钠反应失去0.1mol电子;
C.题中没有告诉氯化铜溶液的体积,无法知道其物质的量;
D.KClO3中不含氯离子.
B.钠原子反应失去一个电子,0.1mol钠反应失去0.1mol电子;
C.题中没有告诉氯化铜溶液的体积,无法知道其物质的量;
D.KClO3中不含氯离子.
解答:
解:A.水标况下是液体,无法根据体积求算其物质的量,故A错误;
B.0.1mol钠反应失去0.1mol电子,转移的电子数目为0.1NA,故B正确;
C.氯化铜溶液的体积不知道,无法求算其物质的量,故C错误;
D.KClO3中不含氯离子,氯酸钾电离呈钾离子和氯酸根,故D错误.
故选B.
B.0.1mol钠反应失去0.1mol电子,转移的电子数目为0.1NA,故B正确;
C.氯化铜溶液的体积不知道,无法求算其物质的量,故C错误;
D.KClO3中不含氯离子,氯酸钾电离呈钾离子和氯酸根,故D错误.
故选B.
点评:本题考查了阿伏伽德罗常数,注重基础知识的考查,注意22.4L/mol的使用条件,标准状况下的气体,本题难度中等.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
铁镍蓄电池,放电时的总反应为:Fe+Ni2O3+3H2O
Fe(OH)2+2Ni(OH) 2下列有关该电池的说法不正确的是( )
| 放电 |
| 充电 |
| A、电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B、电池放电时,负极反应为Fe+2OH--2e-═Fe(OH)2 |
| C、电池充电过程中,阴极附近溶液的pH降低 |
| D、电池充电时,阳极反应为2Ni(OH)2+2OH--2e-═Ni2O3+3H2O |
化学与生产、生活、社会密切相关,下列说法正确的是( )
| A、钢筋混凝土、玻璃钢、石棉瓦、碳纤维增强陶瓷都是常见的复合材料 |
| B、蛋白质、棉花、核酸、PVC、淀粉、油脂都是由高分子组成的物质 |
| C、SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆 |
| D、煤经气化和液化两个物理过程后可变为清洁能源,这是煤综合利用的主要方法 |
下列溶液中Cl-的物质的量浓度与100mL 2mol?L-1MgCl2溶液中Cl-的浓度相等的是( )
| A、150 mL 4mol?L-1NaCl溶液 |
| B、75 mL 1mol?L-1AlCl3溶液 |
| C、75 mL 3mol?L-1CaCl2溶液 |
| D、200 mL 2mol?L-1KCl溶液 |
若某氖原子的质量是a g,一个12C原子的质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )
A、该氖原子的相对原子质量可以表示为
| ||
| B、该氖原子的相对原子质量可以表示为aNA | ||
C、W g该氖原子的物质的量一定是
| ||
| D、12b=NA |
下列晶体熔点高低顺序正确的是( )
| A、NaCl>KCl>SiO2>I2 |
| B、HI>HBr>HCl>HF |
| C、金刚石>SiC>晶体硅 |
| D、Cs>Rb>K>Na |
已知HClO的结构式为H-O-Cl,下列有关说法正确的是( )
| A、氧原子发生SP杂化 |
| B、该分子为V型分子 |
| C、氧原子与H、Cl都形成π键 |
| D、该原子的电子式为H:O:Cl |
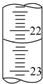 实验室中有一未知浓度的稀盐酸,某学生用0.10mol?L-1 NaOH标准溶液进行测定盐酸的浓度的实验.取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生用0.10mol?L-1 NaOH标准溶液进行测定盐酸的浓度的实验.取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.请完成下列填空: