题目内容
20.在下列事实中,各是什么因素影响了化学反应速率?请填写对应序号:A、催化剂 B、反应物的性质C、反应温度 D、反应物的浓度
①同浓度、同体积的盐酸放入同样大小的锌粒和镁条,产生气体有快有慢:B
②同样大小的石灰石分别与0.1mol•L-1的盐酸和1mol•L-1的盐酸反应,速率不同:D
③夏天食品容易变质,而冬天不易发生该现象:C.
分析 影响反应速率的因素有内因和外因,内因为物质的本身性质,外因有温度、浓度、压强、催化剂、反应物接触面积等,温度和催化剂是通过改变活化分子百分数来改变反应速率,浓度、压强是通过改变单位体积内活化分子个数来改变反应速率,以此解答该题.
解答 解:①镁和锌的性质不同,镁较活泼,与盐酸反应较剧烈,故答案为:B;
②盐酸的浓度不同反应速率不同,即影响因素为浓度,故答案为:D;
③夏天温度高于冬天,温度越高,活化分子百分数越大,其反应速率越大,所以食品在夏天容易变质,冬天则不会出现该现象,故答案为:C.
点评 本题考查化学反应速率影响因素,为高频考点,明确温度、压强、浓度、催化剂、反应物接触面积对化学反应速率影响原理是解本题关键,题目难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
8.下列有关说法正确的是( )
| A. | FeCl3溶液可作外伤止血剂,其原理与胶体知识有关 | |
| B. | C单质可在高温下被浓H2SO4和浓HNO3氧化,而Si 单质不与任何酸反应 | |
| C. | SiO2 分子的空间构型为四面体空间网状结构,因此SiO2晶体硬度大,熔沸点高 | |
| D. | 标准状况下,22.4LSO2和SO3的混合物所含分子数为NA |
15.某有机物的结构简式为: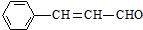 ,则关于该有机物的说法正确的是( )
,则关于该有机物的说法正确的是( )
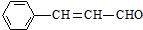 ,则关于该有机物的说法正确的是( )
,则关于该有机物的说法正确的是( )| A. | 1 mol该有机物发生银镜反应能生成 1 mol Ag | |
| B. | 1 mol该有机物最多能够与4 mol H2 发生加成反应 | |
| C. | 它与 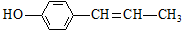 互为同分异构体 互为同分异构体 | |
| D. | 该有机物能使高锰酸钾溶液褪色 |
5.下列化学用语正确的是( )
| A. | H2O的电子式: | B. | K+的离子结构示意图: | ||
| C. | 次氯酸的结构式:H-Cl-O | D. | 羟基的电子式: |
12.同分异构体是指具有( )
| A. | 相同的分子量和不同的结构 | B. | 相同的分子式和不同的结构 | ||
| C. | 相同的分子量和相同的结构 | D. | 相同的分子式和相同的结构 |
9.下列化学用语或表述正确的是( )
| A. | 重水的分子式是H218O | B. | 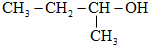 的系统命名为1-甲基-1-丙醇 的系统命名为1-甲基-1-丙醇 | ||
| C. | 氯乙烷官能团的结构式Cl | D. | 次氯酸的电子式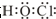 |


 ,加聚反应.
,加聚反应.