题目内容
8.下列有关说法正确的是( )| A. | FeCl3溶液可作外伤止血剂,其原理与胶体知识有关 | |
| B. | C单质可在高温下被浓H2SO4和浓HNO3氧化,而Si 单质不与任何酸反应 | |
| C. | SiO2 分子的空间构型为四面体空间网状结构,因此SiO2晶体硬度大,熔沸点高 | |
| D. | 标准状况下,22.4LSO2和SO3的混合物所含分子数为NA |
分析 A、血液为胶体;
B、硅单质和HF反应;
C、SiO2为原子晶体,不存在分子;
D、标况下三氧化硫为固体;
解答 解:A、血液为胶体,故氯化铁溶液能使血液聚沉,故可作为止血剂,与胶体的性质有关,故A正确;
B、硅单质和一般的酸不反应,但能和HF反应,故B错误;
C、SiO2为原子晶体,不存在单个的二氧化硅分子,故C错误;
D、标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量和分子个数,故D错误.
故选A.
点评 本题考查了胶体性质、硅单质的性质和二氧化硅的结构,难度不大,应注意标况下三氧化硫为固体.

练习册系列答案
相关题目
18.新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti原子的外围电子排布图为 ,电子占据的最高能层具有的原子轨道数为16.
,电子占据的最高能层具有的原子轨道数为16.
②LiBH4由Li+和BH4-构成.BH4-的立体结构是正四面体,B原子的杂化轨道类型是sp3,
BH4-内部含有的微粒间作用力有cd(a.离子键b.非极性键c.极性键d.配位键e.氢键).
Li、B、H元素的电负性由大到小排列顺序为H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
M是Mg (填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,
H-的半径为142pm,NaH的理论密度是$\frac{24×4}{{N}_{A}×48{8}^{3}×1{0}^{-30}}$g•cm-3
(只列算式,不必计算出数值,阿伏加德罗常数为NA)
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti原子的外围电子排布图为
 ,电子占据的最高能层具有的原子轨道数为16.
,电子占据的最高能层具有的原子轨道数为16.②LiBH4由Li+和BH4-构成.BH4-的立体结构是正四面体,B原子的杂化轨道类型是sp3,
BH4-内部含有的微粒间作用力有cd(a.离子键b.非极性键c.极性键d.配位键e.氢键).
Li、B、H元素的电负性由大到小排列顺序为H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,
H-的半径为142pm,NaH的理论密度是$\frac{24×4}{{N}_{A}×48{8}^{3}×1{0}^{-30}}$g•cm-3
(只列算式,不必计算出数值,阿伏加德罗常数为NA)
19.X、Y、Z、P、Q、W、R、T是元素周期表短周期中的常见主族元素,且原子序数依次增大,其相关信息如表:
(1)R在元素周期表中的位置为第三周期VIA族;将Q、W、Z、Y的简单离子的半径从大到小排序N3->O2->Mg2+>Al3+(用离子符号表示)
(2)T的单质易溶于XT4中,理由是:Cl2、CCl4均为非极性分子,相似相溶.
(3)根据下表中信息,判断下列化合物固态的晶体类型(填“离子晶体”…等):
(4)任意写出一个由Y、Z元素分别与氢元素形成的10电子粒子间相互反应的离子方程式:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(5)在25℃、101kPa下,已知13.5g的W固体单质在Z2气体中完全燃烧后恢复至原状态,放热419kJ,写出表示W单质燃烧热的热化学方程式Al(s)+$\frac{3}{2}$O2(g)=$\frac{1}{2}$Al2O3(s)△H=-838kJ/mol.
(6)化合物P2R溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构相似的物质P2R2,其溶液显黄色,则P2R2的电子式为 ,用化学方程式表示P2R溶液在空气中的变质过程4Na2S+O2+2H2O═4NaOH+2Na2S2.
,用化学方程式表示P2R溶液在空气中的变质过程4Na2S+O2+2H2O═4NaOH+2Na2S2.
| 元素 | 相关信息 |
| X | 其一种同位素,可被用作相对原子质量的标准 |
| Y | 其最高价氧化物对应水化物能与其气态氢化物相互间发生化合反应 |
| P | 是短周期中(除稀有气体外)原子半径最大的元素 |
| Q | 存在质量数为25,中子数为13的核素 |
| W | 位于周期表第13列 |
| R | 与Z同族,且最高价氧化物对应水化物的浓溶液常温下与W单质会出现钝化现象 |
(2)T的单质易溶于XT4中,理由是:Cl2、CCl4均为非极性分子,相似相溶.
(3)根据下表中信息,判断下列化合物固态的晶体类型(填“离子晶体”…等):
| 化合物 | X3Y4 | R2T2 |
| 晶体类型 | ||
| 熔点/℃ | >3600 | -76 |
(5)在25℃、101kPa下,已知13.5g的W固体单质在Z2气体中完全燃烧后恢复至原状态,放热419kJ,写出表示W单质燃烧热的热化学方程式Al(s)+$\frac{3}{2}$O2(g)=$\frac{1}{2}$Al2O3(s)△H=-838kJ/mol.
(6)化合物P2R溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构相似的物质P2R2,其溶液显黄色,则P2R2的电子式为
 ,用化学方程式表示P2R溶液在空气中的变质过程4Na2S+O2+2H2O═4NaOH+2Na2S2.
,用化学方程式表示P2R溶液在空气中的变质过程4Na2S+O2+2H2O═4NaOH+2Na2S2.
13.糖类、油脂和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述正确的是( )
| A. | 蛋白质中至少含有四种元素 | |
| B. | 用饱和的CuSO4溶液使蛋清液发生盐析,进而分离、提纯蛋白质 | |
| C. | 所有的糖类、油脂和蛋白质均能发生水解反应 | |
| D. | 油脂在稀硫酸催化条件下的水解又叫皂化反应 |
17.海带中含碘元素,从海带中提取碘有如下步骤:①加入足量双氧水(含稀硫酸);②将海带焙烧成灰后加水搅拌;③加CCl4振荡;④用分液漏斗分液;⑤过滤.合理的操作顺序是( )
| A. | ①②③④⑤ | B. | ①③⑤②④ | C. | ②⑤①③④ | D. | ②①③⑤④ |
 .
.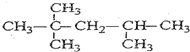 .
.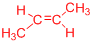 .
.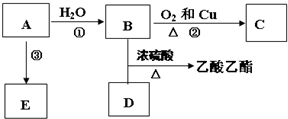
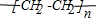 ,E不能(填“能”或“不能”)使酸性KMnO4溶液褪色.
,E不能(填“能”或“不能”)使酸性KMnO4溶液褪色.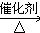 2CH3CHO+2H2O,反应类型氧化反应;B+DCH3COOH+C2H5OH
2CH3CHO+2H2O,反应类型氧化反应;B+DCH3COOH+C2H5OH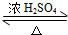 CH3COOC2H5+H2O,反应类型酯化(或取代)反应.
CH3COOC2H5+H2O,反应类型酯化(或取代)反应.