题目内容
5.食盐是日常生活的必需品,也是重要的化工原料.回答下列有关问题:(1)粗食盐常含有少量 Ca2+、Mg2+、SO42-等杂质离子,实验室提纯 NaCl 的流程如图:
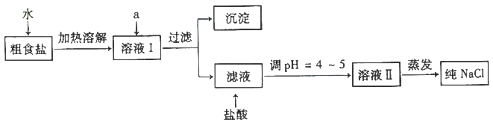
提供的试剂:
Na2CO3溶液、K2CO3溶液、NaOH 溶液、Ca(OH)2溶液、BaCl2溶液、Ba(NO3)2溶液、稀盐酸、稀硫酸、AgNO3溶液.
①欲除去溶液Ⅰ中的 Ca2+、Mg2+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为BaCl2、NaOH、Na2CO3(或NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH)(填化学式).
②过滤之前,怎样检验SO42-已除去:取样于试管中,先滴加足量盐酸酸化,再滴加氯化钡溶液,观察是否产生白色沉淀,未产生则证明已除净,产生则证明未除净.
(2)现需要480mL1.00mol•L-1 NaCl溶液.
①欲配制上述溶液,则所用玻璃仪器中除过滤操作涉及到的外,还需500mL容量瓶、胶头滴管、量筒.
②计算后,需称 NaCl的质量为29.3g.
③下列操作的正确顺序是(用字母表示) B→E→F→C→D→A→G.
A.上下颠倒摇匀 B.称量 C.洗涤 D.定容 E.溶解 F.移液 G.装瓶
④下列操作对所得溶液浓度有何影响,在横线上填写“偏高”、“偏低”或“无影响”.
A.称量时砝码生锈:偏高; B.溶解前烧杯内有水:无影响;
C.容量瓶洗涤后未干燥无影响; D.定容时仰视容量瓶刻度线:偏低.
分析 (1)由流程可知,溶解后加试剂除去杂质,选择NaOH除去镁离子,选择碳酸钠除去钙离子,选择氯化钡除去硫酸根离子,碳酸钠一定在氯化钡之后,过滤后,加盐酸除去过量的碳酸钠,调节pH,蒸发可得到NaCl,选择盐酸、氯化钡检验硫酸根离子;
(2)①需要480mL1.00mol•L-1 NaCl溶液,选择500mL容量瓶,在烧杯中溶解、冷却后转移到容量瓶中定容;
②结合m=cVM计算;
③配制溶液的步骤为计算、称量、溶解、冷却、洗涤、转移、定容、摇匀、装瓶;
④结合c=$\frac{n}{V}$及不当操作对n、V的影响判断.
解答 解:(1)①除去粗盐中的可溶性杂质:Ca2+、Mg2+、SO42-时,可以加入过量NaOH(去除镁离子):Mg2++2OH-=Mg(OH)2↓,加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,则试剂顺序为BaCl2、NaOH、Na2CO3(或NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH),
故答案为:BaCl2、NaOH、Na2CO3(或NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH);
②钡离子遇到硫酸根离子会生成白色沉淀,因此检验硫酸根离子除去的方法为取样于试管中,先滴加足量盐酸酸化,再滴加氯化钡溶液,观察是否产生白色沉淀,未产生则证明已除净,产生则证明未除净,
故答案为:取样于试管中,先滴加足量盐酸酸化,再滴加氯化钡溶液,观察是否产生白色沉淀,未产生则证明已除净,产生则证明未除净;
(2)①需要480mL1.00mol•L-1 NaCl溶液,选择500mL容量瓶,在烧杯中溶解、冷却后转移到容量瓶中定容,则除过滤操作涉及到(烧杯、玻璃棒)外需要的仪器为500mL容量瓶、胶头滴管、量筒,故答案为:500mL容量瓶、胶头滴管、量筒;
②NaCl的质量为0.5L×1mol/L×58.5/mol=29.3g,故答案为:29.3g;
③配制溶液的步骤为计算、称量、溶解、冷却、洗涤、转移、定容、摇匀、装瓶,则操作顺序为B→E→F→C→D→A→G,故答案为:E;F;C;D;A;
④A.称量时砝码生锈,固体质量偏大,n偏大,则浓度偏高,故答案为:偏高;
B.溶解前烧杯内有水对实验无影响,故答案为:无影响;
C.容量瓶洗涤后未干燥对实验无影响,故答案为:无影响;
D.定容时仰视容量瓶刻度线,V偏小,则浓度偏低,故答案为:偏低.
点评 本题考查粗盐提纯及配制一定浓度的溶液,为高频考点,把握粗盐提纯的试剂、溶液配制的步骤及仪器为解答的关键,侧重分析与实验能力的考查,注意结合浓度公式分析误差,题目难度不大.

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案| A. | 2Q2=Q1=92.4 | B. | Q2<Q1<92.4 | C. | Q1<Q2<92.4 | D. | Q1=Q2=92.4 |
| A. | 给反应体系适当加热 | B. | 向反应体系中加水稀释 | ||
| C. | 加入少量氧化铜固体 | D. | 加入催化剂或加压 |
| A. | 1mol纯物质完全燃烧时所放出的热量叫做该物质的燃烧热 | |
| B. | 对于任何化学反应,反应的速率越大,反应现象越明显 | |
| C. | SO2溶于水能导电,所以SO2是电解质 | |
| D. | 某溶液的pH=7,则该溶液不一定为中性 |
| A. | 0.1mol的OH-中含有的电子数为0.9NA | |
| B. | 标准状况下,11.2 L CCl4所含分子数为0.5NA | |
| C. | 6.02×1022个 CH4所含氢原子数为0.4NA | |
| D. | 常温常压下,28 g N2中所含原子个数为NA |


 .
.
 某兴趣小组设计了如图所示的原电池,请结合图中信息回答下列问题:
某兴趣小组设计了如图所示的原电池,请结合图中信息回答下列问题: