题目内容
1. 由短周期元素组成的单质A、B、C和四种化合物甲、乙、丙、丁有如图所示的转化关系,已知C是密度最小的气体,甲是电解质.根据图示转化关系回答问题:
由短周期元素组成的单质A、B、C和四种化合物甲、乙、丙、丁有如图所示的转化关系,已知C是密度最小的气体,甲是电解质.根据图示转化关系回答问题:(1)写出下列物质的化学式:AAl、BO2、乙NaAlO2、丁Al(OH)3.
(2)组成单质A的元素在周期表中的位置是第三周期第ⅢA族,丙的电子式是
 .
.(3)①写出A与NaOH溶液反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
②写出乙与过量CO2反应的离子方程式:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-.
分析 C为密度最小的气体,则C是H2,A和氢氧化钠溶液反应生成乙和氢气,中学阶段学习的能和氢氧化钠溶液反应生成氢气的有Al、Si,乙与过量的二氧化碳反应得到丁,丁为氢氧化铝或硅酸,丁加入失去丙得到甲,丙为H2O,甲为氧化铝或二氧化硅,由于甲是电解质,故甲是Al2O3,可推知A是Al,乙是NaAlO2,丁是Al(OH)3,B是O2,据此解答.
解答 解:C为密度最小的气体,则C是H2,A和氢氧化钠溶液反应生成乙和氢气,中学阶段学习的能和氢氧化钠溶液反应生成氢气的有Al、Si,乙与过量的二氧化碳反应得到丁,丁为氢氧化铝或硅酸,丁加入失去丙得到甲,丙为H2O,甲为氧化铝或二氧化硅,由于甲是电解质,故甲是Al2O3,可推知A是Al,乙是NaAlO2,丁是Al(OH)3,B是O2,
(1)由以上分析可知,A为Al,B为O2,乙为NaAlO2,丁为Al(OH)3,
故答案为:Al;O2;NaAlO2;Al(OH)3;
(2)A为Al,位于周期表第三周期第ⅢA族,丙为H2O,电子式为 ,
,
故答案为:第三周期第ⅢA族; ;
;
(3)①铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
②偏铝酸钠和过量二氧化碳反应生成氢氧化铝和碳酸氢钠,离子反应方程式为:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-,
故答案为:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-.
点评 本题考查无机推断,A与氢氧化钠溶液反应生成氢气及甲为电解质为推断突破口,再结合转化关系推断,明确铝及其化合物的性质是解本题关键,难度中等.

练习册系列答案
相关题目
12.反应3ClO-+2Fe3++10OH-═2FeO42-+5H2O+3Cl-,下列有关该反应的说法中正确的是( )
| A. | ClO-作还原剂 | |
| B. | FeO42-为还原产物 | |
| C. | 每产生1 mol FeO42-,转移3 mol电子 | |
| D. | OH-作氧化剂 |
9.苹果酸的结构简式为 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 苹果酸中能发生酯化反应的官能团有2种 | |
| B. | 1 mol苹果酸可与3 mol NaOH发生中和反应 | |
| C. | 1 mol苹果酸与足量金属Na反应生成1 mol H2 | |
| D. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
16.1,5-戊二醛(简称GA),是一种重要的饱和直链二元醛.2%的GA溶液具有广泛、高效、无刺激、无腐蚀等特点,对防治禽流感、口蹄疫、猪瘟等有良好效果.根据上述信息,判断下列说法中正确的是( )
| A. | 戊二醛分子式为C5H10O2,符合此分子式的二元醛有4种 | |
| B. | 戊二醛不能在加热条件下和新制备的氢氧化铜反应 | |
| C. | 戊二醛不能使酸性KMnO4溶液褪色 | |
| D. | 2%的GA溶液能破坏菌体蛋白质,杀死微生物,具有消毒杀菌作用 |
6.己知葡萄糖的结构简式为CH2OH(CHOH)4CHO,由此判断下列关于葡萄糖性质的叙述中不正确的是( )
| A. | 葡萄糖能发生酯化反应 | |
| B. | 葡萄糖具有还原性 | |
| C. | 葡萄糖充分燃烧的产物为CO2与H2O | |
| D. | 完全燃烧等质量的葡萄糖和甲醛,所需氧气物质的量不相同 |
 [加成反应]
[加成反应] 与NaOH溶液共热:
与NaOH溶液共热: [取代反应].
[取代反应].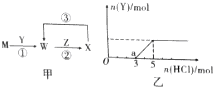
 C6H14
C6H14  C5H10.
C5H10.