题目内容
8.下列叙述正确的是( )| A. | 可用磨口玻璃瓶保存NaOH溶液 | |
| B. | 使用容量瓶配制100g 36%的NaCl溶液 | |
| C. | 稀硝酸可除去试管内壁的银镜 | |
| D. | 加热可除去NaHCO3固体中混有的Na2CO3 |
分析 A.玻璃中二氧化硅与氢氧化钠反应生成具有粘性的硅酸钠溶液;
B.容量瓶为配制一定物质的量浓度溶液专用仪器;
C.依据硝酸具有强的氧化性,能够氧化银生成易溶性硝酸银;
D.依据碳酸氢钠不稳定受热分解生成碳酸钠和水、二氧化碳的性质解答;
解答 解:A.玻璃中含有二氧化硅,能与氢氧化钠反应生成硅酸钠,硅酸钠为无机矿物胶,使瓶塞与瓶口粘连在一起,故A错误;
B.容量瓶为配制一定物质的量浓度溶液专用仪器,不能用于配制100g 36%的NaCl溶液,故B错误;
C.银与稀硝酸反应生成易溶性硝酸银,所以稀硝酸可除去试管内壁的银镜,故C正确;
D.碳酸氢钠不稳定受热分解生成碳酸钠和水、二氧化碳,所以加热可除去碳酸钠固体中混有的碳酸氢钠,故D错误;
故选:C.
点评 本题考查了化学基础实验常识,涉及试剂的保存、仪器的使用、物质的净化除杂,熟悉相关物质的性质是解题关键,题目难度不大.

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
18.下列关于如图装置的说法正确的是( )
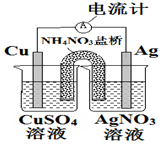

| A. | 盐桥中的NH4+离子向左侧烧杯移动 | |
| B. | 铜电极上发生的反应为Cu-2e-═Cu2+ | |
| C. | 外电路中的电子是从银电极流向铜电极 | |
| D. | 该装置能将电能转化为化学能 |
19.用NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 0.5mol Mg与足量盐酸反应生成氢气的体积为11.2升 | |
| B. | 标准状况下,11.2L SO2所含的原子数为1.5NA | |
| C. | 8gCH4所含的氢原子数为0.5NA | |
| D. | 46g NO2和N2O4的混合物所含的分子数为1NA |
3.1,4-二氧六环是一种常见的溶剂,它可以通过下列方法合成,则烃A为( )
A烃类$\stackrel{Br_{2}}{→}$B$\stackrel{NaOH水溶液}{→}$C$→_{-H_{2}O}^{浓H_{2}SO_{4}}$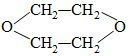
A烃类$\stackrel{Br_{2}}{→}$B$\stackrel{NaOH水溶液}{→}$C$→_{-H_{2}O}^{浓H_{2}SO_{4}}$
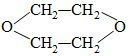
| A. | 乙烯 | B. | 1-丁稀 | C. | 1,3-丁二烯 | D. | 乙炔 |
13.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 常温常压下,44g CO2含有的原子数为3NA | |
| C. | 常温常压下,11.2L氧气所含的原子数为NA | |
| D. | 标准状况下,11.2L H2O 含有的分子数为0.5NA |
20.下列离子方程式书写正确的是( )
| A. | 铁和稀盐酸的反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 铁与氯化铜溶液的反应:2Fe+3Cu2+═2Fe3++3Cu | |
| C. | 醋酸与NaOH溶液的反应:H++OH-═H2O | |
| D. | 碳酸镁与稀硫酸的反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
17.在一定条件下不能发生水解反应的是( )
| A. | 油脂 | B. | 葡萄糖 | C. | 淀粉 | D. | 纤维素 |
18.已知质量分数为98%硫酸密度为1.84g/cm3,则质量分数为49%的硫酸物质的量浓度是( )
| A. | 9.2mol/L | B. | 大于9.2mol/L | C. | 小于9.2mol/L | D. | 无法确定 |