题目内容
18.下列关于如图装置的说法正确的是( )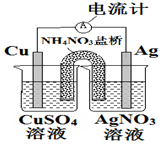
| A. | 盐桥中的NH4+离子向左侧烧杯移动 | |
| B. | 铜电极上发生的反应为Cu-2e-═Cu2+ | |
| C. | 外电路中的电子是从银电极流向铜电极 | |
| D. | 该装置能将电能转化为化学能 |
分析 该装置是将化学能转变为电能的装置,属于原电池,铜易失去电子而作负极,银作正极,铜电极上铜失去电子发生氧化反应,外电路中,电子从负极铜沿导线流向正极银.
解答 解:A.该原电池中,铜是负极,银是正极,盐桥中的NH4+离子向右侧烧杯正极移动,故A错误;
B.铜电极上铜失去电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,故B正确;
C.外电路中的电子从铜电极沿导线流向银电极,故C错误;
D.该装置没有外接电源,是将化学能转变为电能的装置而不是将电能转变为化学能的装置,故D错误.
故选B.
点评 本题考查了原电池原理,根据原电池的定义、电极反应类型、电子的流向来分析解答即可,注意盐桥中阴阳离子的移动方向.

练习册系列答案
相关题目
8. 在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
 在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )| A. | .原溶液的c(H+)=0.08mol/L | B. | 原溶液中n(Mg2+):n(Al3+)=10:1 | ||
| C. | x与y的差值为0.01mol | D. | 原溶液中c(Cl-)=0.066mol/L |
3.如图在置于空气的容器里盛有NaCl溶液,再放入缠绕着铜丝的铁钉,下列叙述正确的是( )

| A. | 铜丝表面有气泡产生 | |
| B. | 铁钉上发生的反应为:Fe-3e-═Fe3+ | |
| C. | 一段时间后铁钉上出现红色物质 | |
| D. | 如果把铜丝换成镁条,会加快铁钉的溶解 |
10.将C(H+)相同,溶液体积也相同的两种酸溶液(甲:盐酸;乙:醋酸)分别与锌反应,若最后有一溶液中有锌剩余,且放出的气体一样多,对此有如下判断:
(1)反应所需时间:乙<甲
(2)开始时反应速率:甲>乙
(3)参加反应的锌的质量:甲=乙
(4)整个反应阶段的平均速率:乙>甲
(5)盛盐酸的容器中有锌剩余
(6)盛醋酸的容器中有锌剩余.
以上判断正确的是( )
(1)反应所需时间:乙<甲
(2)开始时反应速率:甲>乙
(3)参加反应的锌的质量:甲=乙
(4)整个反应阶段的平均速率:乙>甲
(5)盛盐酸的容器中有锌剩余
(6)盛醋酸的容器中有锌剩余.
以上判断正确的是( )
| A. | (1)(2)(3)(5) | B. | (1)(3)(5) | C. | (2)(3)(6) | D. | (1)(3)(4)(5) |
7.下列条件下,对应离子一定能大量共存的是( )
| A. | 在0.1mol/LNaHCO3溶液中:Al3+、NH4+、SO42-、NO3- | |
| B. | 常温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液中:K+,Cl-,Fe2+,NO3- | |
| C. | 使甲基橙变红的溶液中:NH4+,Cl-,SO2-,Mg2+ | |
| D. | 25℃时,水电离出的c(H+)=1×10-13mol/L:K+,Ba2+,NO3-,S2- |
8.下列叙述正确的是( )
| A. | 可用磨口玻璃瓶保存NaOH溶液 | |
| B. | 使用容量瓶配制100g 36%的NaCl溶液 | |
| C. | 稀硝酸可除去试管内壁的银镜 | |
| D. | 加热可除去NaHCO3固体中混有的Na2CO3 |
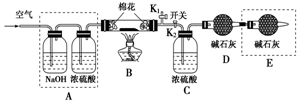 为探究所得的水合碱式碳酸镁[mMgCO3•nMg(OH)2•x
为探究所得的水合碱式碳酸镁[mMgCO3•nMg(OH)2•x