题目内容
11.某有机化合物X能发生水解反应,水解产物为Y和Z.同温同压下,相同质量的Y和Z的蒸气所占体积相同,化合物X不可能是( )| A. | 甲酸乙酯 | B. | 乙酸甲酯 | C. | 乙酸丙酯 | D. | 丙酸丁酯 |
分析 分子中含有n个C原子的饱和一元醇的相对分子质量与分子中含有(n-1)个C原子的饱和一元羧酸的相对分子质量相等,即:Mr(CnH2n+2O)=Mr[C(n-1)H2(n-1)O2]=14n+18;同温同压下,相同质量的Y和Z的蒸气所占的体积相同,根据阿伏加德罗定律可得Y和Z的物质的量相等,进一步推得Y和Z的相对分子质量相等;
解答 解:同温同压下,相同质量的Y和Z的蒸气所占体积相同,根据阿伏加德罗定律可得Y和Z的物质的量相等,进一步推得Y和Z的相对分子质量相等.
A、甲酸乙酯水解生成甲酸和乙醇,相对分子质量均为46,故X可能是甲酸乙酯;
B、乙酸甲酯水解生成乙酸和甲醇,相对分子质量分别为60和32,故X不可能是乙酸甲酯;
C、乙酸丙酯水解生成乙酸和丙醇,其相对分子质量均为60,故X可能是乙酸丙酯;
D、丙酸丁酯水解生成丙酸和丁醇,相对分子质量均为74,故X可能是丙酸丁酯;
故选B.
点评 本题考查有机物的推断,侧重酯的水解及相对分子质量的考查,注意饱和一元醇与比它少1个C的一元羧酸的相对分子质量相同,题目难度不大.

练习册系列答案
相关题目
1.已知,某元素+1价离子的电子排布式为:1s22s22p6,则下列叙述错误的是( )
| A. | 该元素位于周期表的第二周期0族 | |
| B. | 该元素最高价氧化物对应水化物为强碱 | |
| C. | 该元素第一电离能为本周期最小 | |
| D. | 该元素电负性为短周期最小 |
2.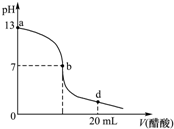 常温下,向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是( )
常温下,向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是( )
 常温下,向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是( )
常温下,向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是( )| A. | 氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线b、d间的某点 | |
| B. | 在b点,c(Na+)=c(CH3COO-) | |
| C. | 在d点,溶液中所有离子浓度由大到小的顺序为c(CH3COO-)>c (Na+)>c (H+)>c (OH-) | |
| D. | 该氢氧化钠溶液的物质的量浓度为0.1 mol/L |
6.下列叙述正确的是( )
| A. | 自然界中大量存在硅单质 | |
| B. | 石英、水晶、硅石的主要成分都是SiO2 | |
| C. | 自然界中SiO2都存在于石英矿中 | |
| D. | SiO2为集成电路和光电池的材料 |
16. 某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
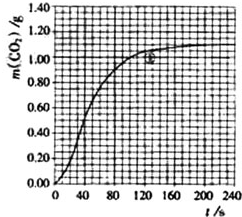
实验①中CO2质量随时间变化的关系如图:
实验①在70-90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)为由图可知70至90S,CO2生成的质量为m(CO2)=0.95g-0.84g=0.11g,物质的量为n(CO2)=0.0025mol,
由$\frac{1}{2}$CaCO3+HNO3═$\frac{1}{2}$Ca(NO3)2+$\frac{1}{2}$CO2↑+$\frac{1}{2}$H2O可知消耗HNO3的物质的量为n(HNO3)=0.0025mol×2=0.005mol,
又溶液体积为25ml=0.025L,所以HNO3减少的浓度△c(HNO3)=$\frac{△n}{V}$=$\frac{0.005mol}{0.025L}$=0.2mol•L-1,
反应时间为90s-70s=20s,所以HNO3在70-90S范围内的平均反应速率为v(HNO3)=$\frac{△c}{△t}$=$\frac{0.2mol•{L}^{-1}}{20s}$=0.01mol•L-1•S-1,
答:70-90s范围内HNO3的平均反应速率为0.01mol•L-1•S-1..
 某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探 究大理石规格(粗、细)对该反 应速率的影响;) |
| ② | ||||
| ③ | ||||
| ④ |
实验①在70-90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)为由图可知70至90S,CO2生成的质量为m(CO2)=0.95g-0.84g=0.11g,物质的量为n(CO2)=0.0025mol,
由$\frac{1}{2}$CaCO3+HNO3═$\frac{1}{2}$Ca(NO3)2+$\frac{1}{2}$CO2↑+$\frac{1}{2}$H2O可知消耗HNO3的物质的量为n(HNO3)=0.0025mol×2=0.005mol,
又溶液体积为25ml=0.025L,所以HNO3减少的浓度△c(HNO3)=$\frac{△n}{V}$=$\frac{0.005mol}{0.025L}$=0.2mol•L-1,
反应时间为90s-70s=20s,所以HNO3在70-90S范围内的平均反应速率为v(HNO3)=$\frac{△c}{△t}$=$\frac{0.2mol•{L}^{-1}}{20s}$=0.01mol•L-1•S-1,
答:70-90s范围内HNO3的平均反应速率为0.01mol•L-1•S-1..
3.有甲、乙、丙三种溶液,进行如下操作:

则甲、乙、丙三种溶液可能是( )

则甲、乙、丙三种溶液可能是( )
| A. | BaCl2、H2SO4、MgCl2 | B. | CaCl2、HNO3、BaCl2 | ||
| C. | CaCl2、HNO3、NaCl | D. | BaCl2、HCl、Na2SO4 |
20.下列关于药物使用的说法中,正确的是( )
| A. | 长期大量服用阿司匹林可预防疾病,没有毒副作用 | |
| B. | 碘酒能使蛋白质变性,常用于外敷消毒 | |
| C. | 使用青霉素可直接静脉注射,不需进行皮肤敏感试验 | |
| D. | 随着平价药房的开设,生病了都可以到药店自己买药服用 |
12.下列浓度关系不正确的是( )
| A. | 氯水中:c(Cl2)═2[c(ClO-)+c(Cl-)+C(HClO)] | |
| B. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| C. | 等体积等浓度的氢氧化钠与醋酸混合:c(Na+)>c(CH3COO-) | |
| D. | Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |