题目内容
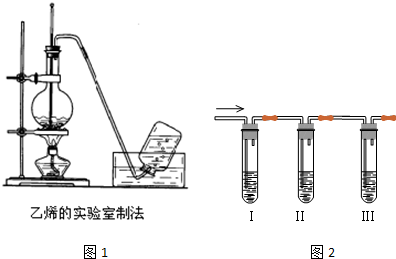
19.实验室可用酒精、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成SO2、CO2、水蒸气等无机物.某研究性学习小组欲用如图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型.回答下列问题:
(1)写出实验室制备乙烯反应的化学方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,实验中,混合浓硫酸与乙醇的方法是将浓硫酸慢慢加入另一种物质中;加热F装置时必须使液体温度迅速(选填缓慢或迅速)升高到170℃,圆底烧瓶中加入几粒碎瓷片的作用是防止暴沸.
(2)为实现上述实验目的,装置的连接顺序为F→A→B→E→C→D.(各装置限用一次)
(3)当C中观察到溶液褪色时,表明单质溴能与乙烯反应;若D中有浅黄色沉淀生成,表明C中发生的是取代反应;若D没有出现前面所描述的现象时,表明C中发生的是加成反应.
分析 乙醇在浓硫酸作用下加热到170℃发生消去反应生成乙烯,因浓硫酸具有强氧化性,可与乙醇发生氧化还原反应,生成的乙烯混有SO2、CO2、水蒸气等无机物,F为乙烯的制备装置,A用于除去SO2、CO2,B用于检验SO2、CO2是否除去,然后在E中用浓硫酸干燥可得到纯净的乙烯,在以此通过C、D,可证明乙烯与溴发生加成反应,C中溴的四氯化碳溶液褪色,D无现象,以此解答该题.
解答 解:(1)乙醇在170℃时发生消去生成乙烯,温度必须是170℃,反应方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,浓硫酸密度大于乙醇,且混合过程中放热大量热,所以应该将浓硫酸加入乙醇中,为了避免副反应发生,应该将反应温度迅速升高到170℃,圆底烧瓶中加入几粒碎瓷片的作用是防止暴沸,
故答案为:
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O;浓硫酸;迅速;防止暴沸;
(2)为得到纯净的乙烯,应用NaOH溶液除去SO2、CO2,(并用石灰水检验是否除尽),然后用浓硫酸干燥;乙烯与单质溴之间可能发生加成反应,也可能发生取代反应,若是取代反应,则会有HBr生成,HBr与AgNO3溶液反应会产生浅黄色沉淀,所以装置连接顺序为:F→A→B→E→C→D,
故答案为:A→B→E→C;
(3)当C中观察到溴水褪色时,表明单质溴能与乙烯反应;若D中硝酸银溶液中出现浅黄色沉淀时,表明C中生成了溴化银沉淀,发生的是取代反应;
若D没有出现前面所描述的现象时,表明C中发生的是加成反应,
故答案为:溶液褪色;有浅黄色沉淀生成.
点评 本题综合考查乙醇的消去反应、乙烯的性质检验,为高频考点,题目难度不大,注意掌握乙醇的化学性质、乙烯性质及检验方法,明确实验原理为解答本题的关键,试题培养了学生灵活应用所学知识的能力.

| A. | K、Na、Al | B. | O、Cl、H | C. | Si、P、H | D. | O、S、Cl |
| A. | 同族元素,随着核外电子层数的增加,I1逐渐增大 | |
| B. | 通常情况下,对于同一种元素的原子,其电离能I1<I2<I3 | |
| C. | 同周期元素,总体变化趋势是随着核电荷数的增加,I1增大 | |
| D. | 通常情况下,电离能越小,元素的金属性越强 |
①晶体中含有受热不分解的杂质;
②晶体尚带蓝色,即停止加热;
③加热过程中,晶体有部分爆溅飞出坩埚.
其中能使实验结果n值偏低的是( )
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③ |
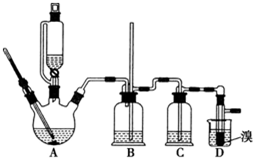 实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{1700℃}^{H_{2}SO_{4}(浓)}$CH2=CH
实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{1700℃}^{H_{2}SO_{4}(浓)}$CH2=CHCH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在 l40℃脱水生成乙醚. 用少量的溴和足量的乙醇制备 1,2-二溴乙烷的装置如图所示:
有关数据列表如下
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制各实验中,要尽可能迅速地把反应温度提高到 170℃左右,其最主要目 的是d;(填正确选项前的字母)
a.引发反应b.加快反应速度c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置 C 中应加入c,其目的是吸收反应中可能生成的酸 性气体:(填正确选项前的字母)
a.水b.浓硫酸 c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将 1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层 (填“上”、“下”);
(5)若产物中有少量未反应的 Br2,最好用b洗涤除去;(填正确选 项前的字母)
a.水b.氢氧化钠溶液c.碘化钠溶液d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置 D,其主要目的是冷却可避免溴的大量挥发; 但又不能过度冷却 (如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
| A. | 制乙烯时,用排水法或向上排空气法收集气体 | |
| B. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 | |
| C. | 制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 | |
| D. | 制二氧化氮时,用水或NaOH溶液吸收尾气 |
 某课外活动小组探索苯与液溴的反应是否属于取代反应,设计了如下实验装置.
某课外活动小组探索苯与液溴的反应是否属于取代反应,设计了如下实验装置.