题目内容
6.在相同温度下,甲、乙两种溶液,甲溶液的pH是乙溶液的2倍,则甲溶液中c(H+)甲与乙溶液中c(H+)乙之比是( )| A. | 10:1 | B. | 100:1 | C. | 1:100 | D. | 无法确定 |
分析 设乙的pH为x,甲的pH为2x,则甲中c(H+)=10-2xmol/L,乙中c(H+)=10-xmol/L,据此分析.
解答 解:设乙的pH为x,甲的pH为2x,则甲中c(H+)=10-2xmol/L,乙中c(H+)=10-xmol/L,则甲溶液中c(H+)甲与乙溶液中c(H+)乙之比为$\frac{1{0}^{-2x}}{1{0}^{-x}}$=10-x,由于x的值未知,则之比无法确定,故选D.
点评 本题考查pH的计算,注意根据溶液中氢离子浓度与pH的计算公式计算,解答时要考虑溶液的酸碱性的可能性,题目难度中等.

练习册系列答案
相关题目
16.下列属于放热的氧化还原反应的是( )
| A. | 二氧化碳与赤热的炭反应生成一氧化碳 | |
| B. | 葡萄糖在人体内氧化 | |
| C. | 生石灰制熟石灰 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应 |
14.实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热.图是实验室利用此反应制备氯气并进行一系列相关实验的装置(夹持设备已略).
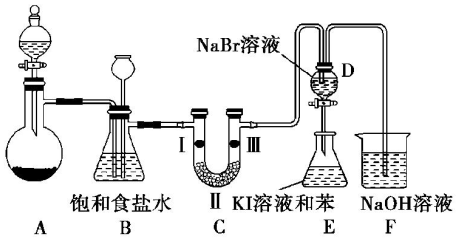
(1)上述反应中KClO3是氧化剂,HCl是还原剂,若反应中氧化产物比还原产物多 1mol,则转移的电子数目为2.5NA.
(2)装置B的作用是除杂和安全瓶,实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:锥形瓶中的液面下降,长颈漏斗中的液面上升.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入c(选“a”“b”或“c”)
(4)设计装置D、E 的目的是为了比较Cl2、Br2、I2的氧化性强弱. 已知Br2 的水溶液因浓度不同而呈现橙色或红棕色,I2难溶于水而易溶苯,且 I2 的苯溶液为紫红色.当向D中缓缓通入足量Cl2时,可以看到无色溶液逐渐变为红棕色,说明 Cl2的氧化性大于 Br2,请写出D中对应的离子方程式并用双线桥法表示出电子转移情况: .打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象不能( 填“能”或“不能”)说明Br2的氧化性大于I2.
.打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象不能( 填“能”或“不能”)说明Br2的氧化性大于I2.
(5)装置F的作用是除去污染性的物质(Cl2、Br2 等),已知Cl2与NaOH反应时产物中可能有NaCl、NaClO、NaClO3,且$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$值与温度高低有关. 若烧杯中装有500mL0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为1.12L(忽略Cl2溶于水).

(1)上述反应中KClO3是氧化剂,HCl是还原剂,若反应中氧化产物比还原产物多 1mol,则转移的电子数目为2.5NA.
(2)装置B的作用是除杂和安全瓶,实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:锥形瓶中的液面下降,长颈漏斗中的液面上升.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入c(选“a”“b”或“c”)
| a | b | c | |
| Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
 .打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象不能( 填“能”或“不能”)说明Br2的氧化性大于I2.
.打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象不能( 填“能”或“不能”)说明Br2的氧化性大于I2.(5)装置F的作用是除去污染性的物质(Cl2、Br2 等),已知Cl2与NaOH反应时产物中可能有NaCl、NaClO、NaClO3,且$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$值与温度高低有关. 若烧杯中装有500mL0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为1.12L(忽略Cl2溶于水).
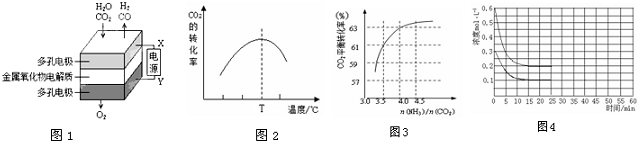
1.根据相应的图象(图象编号与答案一一对应),判断下列相关说法正确的是( )


| A. | t1时改变某一条件有如图所示变化,则改变的条件一定是加入催化剂 | |
| B. | 反应达到平衡时,外界条件对平衡影响关系如图所示,若b=1,a为正整数,则P1<P2 | |
| C. | 从加入反应物开始,物质的百分含量与温度关系如图所示,则该反应的正反应为吸热反应 | |
| D. | 反应速率和反应条件变化如图所示,则该反应正反应为放热反应,A、B一定是气体,D一定不是气体,C可能不是气体 |
6.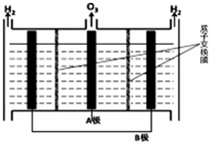 NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,请根据题意回答下列问题:
NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,请根据题意回答下列问题:
Ⅰ.利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g)△H=-748kJ/mol
为了测定某催化剂作用下的反应速率,在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生上述反应.用气体传感器测得不同时间NO浓度如表:
(1)前2s内的平均反应速率υ(N2)=2.08×10-4mol/(L•s)(保留3位有效数字,下同);计算此温度下该反应的K=3.65×106.
(2)达到平衡时,下列措施能提高NO转化率的是BD.(填字母序号)
A.选用更有效的催化剂B.降低反应体系的温度
C.充入氩气使容器内压强增大D.充入CO使容器内压强增大
(3)已知N2(g)+O2(g)=2NO(g)△H=+180kJ/mol;则CO完全燃烧的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-284kJ/mol.
Ⅱ.臭氧也可用于处理NO.
(4)O3氧化NO结合水洗可产生HNO3和O2,每生成1mol的HNO3转移3mol电子.
(5)O3可由电解稀硫酸制得,原理如右图.图中阴极为B(填“A”或“B”),阳极(惰性电极)的电极反应式为3H2O-6e-=O3+6H+.
 NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,请根据题意回答下列问题:
NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,请根据题意回答下列问题:Ⅰ.利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g)△H=-748kJ/mol
为了测定某催化剂作用下的反应速率,在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生上述反应.用气体传感器测得不同时间NO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
(2)达到平衡时,下列措施能提高NO转化率的是BD.(填字母序号)
A.选用更有效的催化剂B.降低反应体系的温度
C.充入氩气使容器内压强增大D.充入CO使容器内压强增大
(3)已知N2(g)+O2(g)=2NO(g)△H=+180kJ/mol;则CO完全燃烧的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-284kJ/mol.
Ⅱ.臭氧也可用于处理NO.
(4)O3氧化NO结合水洗可产生HNO3和O2,每生成1mol的HNO3转移3mol电子.
(5)O3可由电解稀硫酸制得,原理如右图.图中阴极为B(填“A”或“B”),阳极(惰性电极)的电极反应式为3H2O-6e-=O3+6H+.
4.下列实验操作能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 制备氨气 | 将浓氨水逐滴滴入CaO固体中 |
| B | 制备氯气 | 将浓盐酸逐滴滴入浓硫酸 |
| C | 制备氧气 | 向双氧水中滴入ZnSO4溶液 |
| D | 制备氢气 | 酒精灯加热碳与水的混合物 |
| A. | A | B. | B | C. | C | D. | D |